
【题目】CuCl为白色粉末,微溶于水,不溶于乙醇,潮湿的CuCl在空气中被氧化为Cu2(OH)3Cl。
(1)一种由海绵铜(Cu)为原料制备CuCl的工艺流程如下:

①“溶解”步骤发生反应的离子方程式为_________________________________;
②潮湿的CuCl在空气中被氧化的化学反应方程式为_________________________________;
③已知常温下Cu(OH)2溶度积常数Ksp=2×10-20要使c(Cu2+)=0.2 mol·L-1的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的千分之一)则应调节溶液pH为___________以上。
(2)次磷酸(H3PO2)是一元中强酸,可用于作金属表面处理剂。
①向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的化学方程式:_____________;
②H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。在该过程中,氧化剂与还原剂的物质的量之比为:___________;
③NaH2PO2的水溶液呈弱碱性,用离子方程式说明原因:______________________。
【答案】3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O 4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl 6 Ba(H2PO2)2+H2SO4=2H3PO2+BaSO4↓ 4:1 H2PO2- + H2O![]() H2PO2- + OH-
H2PO2- + OH-
【解析】
(1)①“溶解”时NO3-在酸性条件下有氧化性,能溶解铜,相当于铜与稀硝酸的反应;
②结合题中所给出的反应物、生成物书写相关方程式;
③利用Cu(OH)2溶度积常数,通过计算调节pH,使铜离子浓度变为原来的千分之一;
(2)①根据强酸制弱酸原理,向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,同时生成BaSO4沉淀,则发生反应的化学方程式:Ba(H2PO2)2+H2SO4=2H3PO2+BaSO4↓;
②根据氧化还原反应中得失电子守恒,判断出氧化剂与还原剂的物质的量之比;
③NaH2PO2是强碱弱酸盐,H2PO2- 在溶液中水解使溶液呈碱性。
(1)①“溶解”时NO3-在酸性条件下有氧化性,能溶解铜,发生反应的离子方程式:3Cu+2 NO3-+8H+=3Cu2++2NO↑+4H2O ;
②潮湿的CuCl在空气中被氧化Cu2(OH)3Cl的化学反应方程式:4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl;
③要使c(Cu2+)=0.2 mol·L-1的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的千分之一),Ksp(Cu(OH)2)=0.2![]() 10-3
10-3![]() c2(OH-)=2×10-20,c(OH-)=1.0×10-8mol·L-1,pH=6,故应调节溶液pH为6以上;
c2(OH-)=2×10-20,c(OH-)=1.0×10-8mol·L-1,pH=6,故应调节溶液pH为6以上;
(2)①根据强酸制弱酸原理,向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,同时生成BaSO4沉淀,则发生反应的化学方程式:Ba(H2PO2)2+H2SO4=2H3PO2+BaSO4↓;
②H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物,应为H3PO4,H3PO2作还原剂,H3PO2→H3PO4,P元素的化合价从+1→+5,升高4价;Ag+作氧化剂Ag+→Ag,Ag元素的化合价从+1→0,降低1价,氧化还原反应中得失电子守恒,4、1的最小公倍数是4,氧化剂与还原剂的物质的量之比为4:1;
③NaH2PO2是强碱弱酸盐,H2PO2- 在溶液中水解使溶液呈碱性,水解的离子方程式:H2PO2- + H2O![]() H2PO2- + OH-。
H2PO2- + OH-。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D、E 都是周期表中前四周期的元素,且原子序数依次增大,其中 A 原子核外 有三个未成对电子;A 与 B 可形成离子化合物 B3A2;C 元素是地壳中含量最高的金属元素;D 原 子核外的 M 层中有两对成对电子;E 原子核外最外层只有 1 个电子,其余各层电子均充满。以下 有关说法正确的是
A.A 离子半径小于 B 离子半径
B.B 和 C 的氯化物晶体类型相同
C.C 和 D 形成的二元化合物不能通过复分解反应得到
D.E 在周期表中位于第四周期 s 区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是__________________(用离子方程式表示)。
为将碱洗后槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为________________________________________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______________________________________________________________。
(3)利用如图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(1)在原子经济学原则引导下,化学家用CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式___。
(2)以甲醇做燃料的电池,如图所示,其负极是___(填a或b),负极的反应式为___,正极的反应式为___。该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:___Cr2O72-+__Fe2++__H+—__Cr3++__Fe3++__H2O。现有0.12g工业甲醇,在H2SO4溶液中与25mL0.2mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1mol·L-1FeSO4与其反应,结果用去FeSO4溶液9.6mL。
(1)配平第②步的离子方程式___。
(2)计算工业甲醇的质量分数___。
(3)工业上通常利用SiO2和碳反应来制取硅,写出反应的化学方程式__。
工业上还可以利用镁制取硅,反应为2Mg+SiO2=2MgO+Si,同时会发生副反应:2Mg+Si=Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
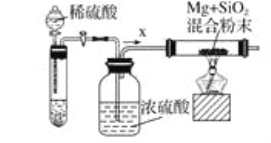
(4)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用__(填序号)。
A.石灰石 B.锌粒 C.纯碱
(5)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是__;当反应引发后,移走酒精灯,反应能继续进行,其原因是__。
(6)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃。用化学方程式表示这两个反应①___,②___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
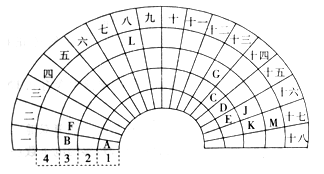
(1)元素C的最高价氧化物的电子式为____;元素G的离子结构示意图为____。
(2)元素L位于周期表的第_________族,1mol/L LM2溶液500mL与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_____性,原因是____________(用离子方程式表示)。
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的物质的量之比为1:3,则该反应的化学方程式为___________。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
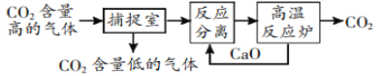
下列有关该方法的叙述中正确的是( )
①能耗大是该方法的一大缺点
②整个过程中,只有一种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
A.①④B.②③C.③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。
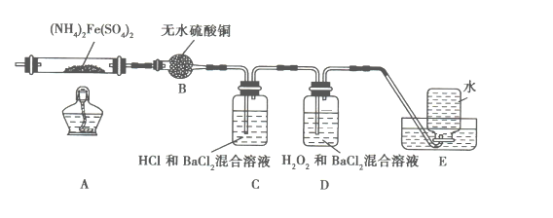
(1)B装置的作用是_________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______气体产生,写出D中发生反应的离子方程式________。
(3)A中固体分解后产生NH3,写出其两种用途_________。
(4)用实验的方法验证C溶液含有NH4+:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示,下列说法错误的是( )
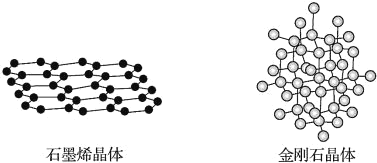
A.在石墨烯晶体中,每个C原子连接3个六元环
B.石墨烯晶体中的化学键全部是碳碳单键
C.在金刚石晶体中,C原子采用sp3杂化
D.在金刚石晶体中,六元环中最多有4个C原子在同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com