
【题目】工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:___Cr2O72-+__Fe2++__H+—__Cr3++__Fe3++__H2O。现有0.12g工业甲醇,在H2SO4溶液中与25mL0.2mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1mol·L-1FeSO4与其反应,结果用去FeSO4溶液9.6mL。
(1)配平第②步的离子方程式___。
(2)计算工业甲醇的质量分数___。
(3)工业上通常利用SiO2和碳反应来制取硅,写出反应的化学方程式__。
工业上还可以利用镁制取硅,反应为2Mg+SiO2=2MgO+Si,同时会发生副反应:2Mg+Si=Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
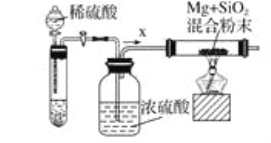
(4)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用__(填序号)。
A.石灰石 B.锌粒 C.纯碱
(5)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是__;当反应引发后,移走酒精灯,反应能继续进行,其原因是__。
(6)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃。用化学方程式表示这两个反应①___,②___。
【答案】1 6 14 2 6 7 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 90.7% SiO2+2C![]() Si+2CO↑ B 防止加热条件下H2与空气混合爆炸 Mg与SiO2的反应是放热反应 Mg2Si+4HCl=2MgCl2+SiH4↑ SiH4+2O2=SiO2+2H2O
Si+2CO↑ B 防止加热条件下H2与空气混合爆炸 Mg与SiO2的反应是放热反应 Mg2Si+4HCl=2MgCl2+SiH4↑ SiH4+2O2=SiO2+2H2O
【解析】
(1)依据氧化还原反应的元素化合价变化结合电子守恒计算配平离子方程式,电子转移:Cr2O72-~2Cr3+~6e-;6Fe2+~6Fe3+~6e-;所以根据电子守恒,结合电荷守恒和原子守恒得到配平的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)由反应②可知,反应①剩余的n(Cr2O72-)=n(Fe2+)÷6=9.6×10-3L× 1mol·L-1÷6 =0.0016 mol,反应①消耗的n(Cr2O72-)=25×10-3L× 0.2mol·L-1-0.0016mol= 0.0050 mol-0.0016 mol=0.0034 mol,则:n(CH3OH)=0.0034 mol,ω(CH3OH)=![]() ×100%=90.7%;
×100%=90.7%;
(3)工业上通常利用SiO2和碳反应来制取硅,同时生成CO,反应的化学方程式SiO2+2C![]() Si+2CO↑。
Si+2CO↑。
(4)Mg可以与CO2反应生成氧化镁和碳,Mg与氢气不能反应,因此可用氢气作为保护气,选用的药品为稀硫酸和锌粒,再用浓硫酸干燥,所以试管中的固体药品可选用锌粒,故选B;
(5)装置中有空气,若不用氢气排空装置中的空气,氢气和空气的混合气体加热会发生爆炸,所以反应开始前应该先通氢气排尽装置中的空气;
Mg与SiO2反应的条件是加热,停止加热后,反应能继续进行,其原因是:Mg与SiO2反应放出的热量维持反应的进行;
(6)Mg2Si遇盐酸迅速反应生成SiH4(硅烷),其反应的方程式为:Mg2Si+4HCl═2MgCl2+SiH4↑,SiH4常温下是一种不稳定、易自燃的气体,SiH4自燃的方程式为SiH4+2O2═SiO2+2H2O,所以往反应后的混合物中加入稀盐酸,可观察到闪亮的火星。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是
A.CH≡C-CH=CH-CH3 中σ键和π键数目之比为 10:3
B.![]() 分子中不含手性碳原子
分子中不含手性碳原子
C.硫难溶于水,微溶于酒精,易溶于 CS2,说明极性:水>酒精>CS2
D.由 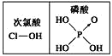 知酸性:H3PO4>HClO
知酸性:H3PO4>HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与阿伏加德罗常数的值(NA)有关的说法正确的是
A. 标准状况下,44.8LHF中含有氢原子的数目为2NA
B. 8.0gCu2S和 CuO的混合物中含有铜原子数为0.1NA
C. 0.2mol·L-1的碳酸钠溶液中CO32-的数目小于0.2NA
D. 1LpH=3的盐酸与1LpH=3的CH3COOH溶液中,水电离出的H+数目均为10-3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图装置进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )
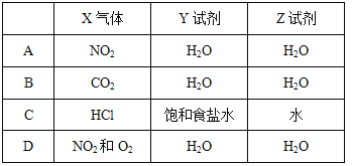
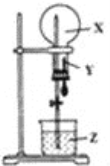
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的反应为SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,此温度下,该反应的平衡常数为
SO3(g) △H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,此温度下,该反应的平衡常数为
A.1B.3C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl为白色粉末,微溶于水,不溶于乙醇,潮湿的CuCl在空气中被氧化为Cu2(OH)3Cl。
(1)一种由海绵铜(Cu)为原料制备CuCl的工艺流程如下:

①“溶解”步骤发生反应的离子方程式为_________________________________;
②潮湿的CuCl在空气中被氧化的化学反应方程式为_________________________________;
③已知常温下Cu(OH)2溶度积常数Ksp=2×10-20要使c(Cu2+)=0.2 mol·L-1的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的千分之一)则应调节溶液pH为___________以上。
(2)次磷酸(H3PO2)是一元中强酸,可用于作金属表面处理剂。
①向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的化学方程式:_____________;
②H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。在该过程中,氧化剂与还原剂的物质的量之比为:___________;
③NaH2PO2的水溶液呈弱碱性,用离子方程式说明原因:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙两个容积相同的密闭容器,分别充入NH3和N2,当它们的温度和密度都相同时,下列说法中正确的是( )
A.两容器气体的质量相等B.两容器气体所含分子数相等
C.两容器气体所含原子数相等D.两容器中气体的压强相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W是否位于同一周期(填“是”或“否”):__________,理由是________________。
(2)Y是_______,Z是_______,W是_______。
(3)X、Y、Z和W可组成一种化合物,其原子个数比为8∶2∶4∶1,写出该化合物的名称及化学式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaAs晶体的熔点很高, 硬度很大, 密度为ρ g·cm-3,Ga 和As 的摩尔质量分别为MGag·mol-1和MAs g·mol-1, 原子半径分别为rGa pm 和rAs pm, 阿伏加德罗常数值为NA, 其晶胞结构如下图所示, 下列说法错误的是
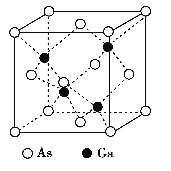
A. 该晶体为原子晶体
B. 在该晶体中,Ga和As均无孤对电子,Ga和As的配位数均为4
C. 原子的体积占晶胞体积的百分率为![]()
D. 所有原子均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com