
����Ŀ��GaAs������۵�ܸ�, Ӳ�Ⱥܴ�, �ܶ�Ϊ�� g��cm-3,Ga ��As ��Ħ�������ֱ�ΪMGag��mol-1��MAs g��mol-1, ԭ�Ӱ뾶�ֱ�ΪrGa pm ��rAs pm, �����ӵ�����ֵΪNA, �侧���ṹ����ͼ��ʾ, ����˵���������
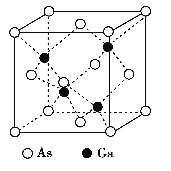
A. �þ���Ϊԭ�Ӿ���
B. �ڸþ�����,Ga��As���¶Ե���,Ga��As����λ����Ϊ4
C. ԭ�ӵ����ռ��������İٷ���Ϊ![]()
D. ����ԭ�Ӿ�����8�����ȶ��ṹ
���𰸡�C
��������
A��GaAs ������۵�ܸߣ�Ӳ�Ⱥܴ���ԭ�Ӿ�����ص���
B���ɾ����ṹ��֪��������As��Gaԭ����Ŀ֮��Ϊ1��1��As��Ga��λ����ͬ��Ga����Χ4��Asԭ���γ���������ṹ��As����Χ4��Gaԭ��Ҳ�γ���������ṹ��ԭ�Ӿ��γ�4������Gaԭ�Ӽ۵���Ϊ3����As�γ�4�����ۼ���˵��Asԭ���ṩ1�Թµ��ӶԸ�Ga�γ���λ����
C����̯�����㾧���и�ԭ����Ŀ���ټ���ԭ�������������ܶȼ��㾧��������ռ�������=�������ԭ�������/���������100%��
D��ÿ��As��Gaԭ�Ӷ��γ�4�����ۼ�����û�йµ��Ӷԡ�
A��GaAs ������۵�ܸߣ�Ӳ�Ⱥܴ�Ϊ�ռ�������վ�ṹ������ԭ�Ӿ��壬��A��ȷ��
B���ɾ����ṹ��֪��Ga����λ��Ϊ4��������Gaԭ����Ŀ=4��Asԭ����Ŀ=8��1/8+6��1/2=4��������As��Gaԭ����Ŀ֮��Ϊ1��1����As��λ��Ҳ��4��Ga����Χ4��Asԭ���γ���������ṹ��As����Χ4��Gaԭ��Ҳ�γ���������ṹ��ԭ�Ӿ��γ�4������Gaԭ�Ӽ۵���Ϊ3����As�γ�4�����ۼ���˵��Asԭ���ṩ1�Թµ��ӶԸ�Ga�γ���λ����Asԭ�������5������ȫ���ɼ�����û�йµ��Ӷԣ���B��ȷ��
C��������ԭ�������=4��4/3�У�rGa3+rAs3 ����10-30 cm3����������=4��(MGa+MAs)/NA g���������=��4��(MGa+MAs)/NA g���¦� g��cm-3��ԭ�ӵ����ռ��������İٷ���=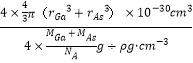 ��100%=4�Ц�NA(r3Ga+r3As)/3(MGa+MAs)��10-30��100%����C����
��100%=4��NA(r3Ga+r3As)/3(MGa+MAs)��10-30��100%����C����
D��ÿ��As��Gaԭ�Ӷ��γ�4�����ۼ�����û�йµ��Ӷԣ�����ԭ�Ӿ����� 8 �����ȶ��ṹ����D��ȷ��
��ѡ��C��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�仰������������ֵ��ǰ��Ϊ![]() ������Ϊ
������Ϊ![]() ��
��![]() ��
��![]() �Ĺ�ϵ��A��B��C��D��ѡ����ա�
�Ĺ�ϵ��A��B��C��D��ѡ����ա�
A.![]() B.
B.![]() C.
C.![]() D.���Ƚ�
D.���Ƚ�
��1��������![]() ��
��![]() ��
��![]()
![]() �������Ϻ���Һ��
�������Ϻ���Һ��![]() ��
��![]() ��______��
��______��
��2��ͬ�¶��£�![]()
![]() ��Һ��
��Һ��![]() ˮ��ٷ�����
ˮ��ٷ�����![]() ��Һ��
��Һ��![]() ��ˮ��ٷ��ʣ�______��
��ˮ��ٷ��ʣ�______��
��3��pHֵ��ͬ�Ĵ�������ᣬ�ֱ�������ˮϡ����ԭ����![]() ����
����![]() ����ϡ�ͺ�����Һ��
����ϡ�ͺ�����Һ��![]() ֵ��Ȼ��ͬ����
ֵ��Ȼ��ͬ����![]() ��
��![]() �Ĺ�ϵ�ǣ�______��
�Ĺ�ϵ�ǣ�______��
��4�����������ݵ�Ũ�ȵĴ�����Һ�����ڶ��������¶ȣ�����Һ��![]() ��______��
��______��
��5����ͬ�¶��£�![]() ֵΪ12���ռ���Һ��ˮ�ĵ���Ⱥ�
ֵΪ12���ռ���Һ��ˮ�ĵ���Ⱥ�![]() ֵΪ12��
ֵΪ12��![]() ��Һ��ˮ�ĵ���ȣ�______��
��Һ��ˮ�ĵ���ȣ�______��
��6����![]() ֵΪ2������ʹ��ᶼϡ����ͬ��������ϡ��Һ��
ֵΪ2������ʹ��ᶼϡ����ͬ��������ϡ��Һ��![]() ֵ��______��
ֵ��______��
��7��������ijǿ���ijǿ����Һ�������Ϻ���Һ��![]() ֵΪ7��ԭ����Һ��ԭ����Һ�����ʵ���Ũ�ȣ�______��
ֵΪ7��ԭ����Һ��ԭ����Һ�����ʵ���Ũ�ȣ�______��
��8����ͬ�¶��£�![]() ��
��![]() ��Һ�е�
��Һ�е�![]() ������
������![]()
![]() ��Һ��
��Һ��![]() �ĸ�����______��
�ĸ�����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeI2��FeBr2�Ļ����Һ��ͨ��������������Һ��ijЩ���ӵ����ʵ����仯�����ͼ��ʾ��������˵���в���ȷ����

A.��ԭ�ԣ�I-��Fe2+��Br-
B.ԭ�����Һ��FeBr2�����ʵ���Ϊ3mol
C.�߶�AB��ʾFe2+����������
D.ԭ��Һ�У�n��Fe2+����n��I-����n��Br-���T2��1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������¸���˵��:
�ٽ����ͷǽ�������ʱһ���γ����Ӽ�;
�����Ӽ��������ӡ������ӵ��������;
�۸��ݵ��뷽��ʽHCl![]() H++Cl-,�ж��Ȼ��������������Ӽ�;
H++Cl-,�ж��Ȼ��������������Ӽ�;
�������������ķ�Ӧ����:H2��Cl2�����ﹲ�ۼ�������������Hԭ�ӡ�Clԭ��,����Hԭ�ӡ�Clԭ���γ����Ӽ��Ĺ���
��������˵����ȷ����
A. �٢� B. ������ȷ C. �٢ڢ� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20����90���ĩ��,��ѧ�ҷ��ֲ�֤��̼���µĵ�����̬![]() ���ڡ�������������̵õ���
���ڡ�������������̵õ���![]() ��
��![]() ��
��![]() ��
��![]() ������һЩ��̼���ӡ�21���ͳ�,��ѧ���ַ����˹�״̼���Ӻ����״̼����,���ḻ��̼Ԫ�ص��ʵļ��塣�����й�˵���������
������һЩ��̼���ӡ�21���ͳ�,��ѧ���ַ����˹�״̼���Ӻ����״̼����,���ḻ��̼Ԫ�ص��ʵļ��塣�����й�˵���������

A. �۵�Ƚ�: ![]()
B. ![]() ��
��![]() ����״̼�����״̼֮���ת�����ڻ�ѧ�仯
����״̼�����״̼֮���ת�����ڻ�ѧ�仯
C. ![]() ����ṹ����ͼ��ʾ,ÿ��
����ṹ����ͼ��ʾ,ÿ��![]() ������Χ��������ҵȾ����
������Χ��������ҵȾ����![]() ������12��
������12��
D. ![]() ��
��![]() ����״̼�����״̼��������
����״̼�����״̼��������![]() ������Ӧ
������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ�ص�һ��ͬλ��X��ԭ��������ΪA����N�����ӣ�����![]() ԭ�����HmX���ӣ���a��HmX���������ӵ����ʵ����ǣ� ��
ԭ�����HmX���ӣ���a��HmX���������ӵ����ʵ����ǣ� ��
A. ![]() (A-N+m)molB.
(A-N+m)molB. ![]() (A-N)molC.
(A-N)molC. ![]() (A-N)molD.
(A-N)molD. ![]() (A-N+m)mol
(A-N+m)mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п�̸ɵ���������ʵ�õ�ء��������й��ջ������������еĽ�������������δ��������

��1������п�̵�ط�ӦΪ��Zn+2MnO2+2H2O��Zn(OH)2+2MnO(OH)���������KOH�� MnO��OH����Mn�Ļ��ϼ�Ϊ��_____,������ӦʽΪ:__________��
��2���ڷ۵���Ҫ�ɷ�Ϊ MnO2��ʯī��д����Ӧ�ٵĻ�ѧ����ʽ��________
��3��MnO2��ת�������¶ȵĹ�ϵ���±���
�¶�/�� | 20 | 40 | 60 | 80 | 100 |
ת����/�� | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
�����г�ѡ��Ӧ�¶�Ϊ80�棬�������ǣ�___________��
��4�������������������ɼ�ʽ̼����[MnCO36Mn(OH)25H2O]��д�������ӷ�Ӧ����ʽ��_______����Һ���пɻ��յ�����Ϊ��________���ѧʽ����
��5���������ữ��![]() ��Һ�����չ�ҵ�����е�
��Һ�����չ�ҵ�����е�![]() ����
����![]() ����֪��Һ��
����֪��Һ��![]() ����Ϊ
����Ϊ![]() ����ҵ������
����ҵ������![]() ����Ϊ
����Ϊ![]() ��
�� ![]() �������ʿɴ�90%������1000
�������ʿɴ�90%������1000![]() ��ҵβ�����ɵõ�
��ҵβ�����ɵõ�![]() ������Ϊ____kg(�ú���ĸ�Ĵ���ʽ��ʾ)��
������Ϊ____kg(�ú���ĸ�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A.ͭ�ۼ����Ȼ�����Һ�У�Cu + Fe3+ = Fe2+��Cu2+
B.��ϡ�������ͭƬ�ϣ�Cu + 2H+ =Cu2++ H2��
C.�������ռ���Һ��Ӧ��Cl2��2OH��=ClO����Cl����H2O
D.������ͭм����ϡ�����У�Cu��4H+��2NO![]() = Cu2+��2NO2����2H2O
= Cu2+��2NO2����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����Ʊ�SO2����֤SO2ijЩ���ʵ�װ��ͼ���Իش�

��1��д������A������___��д����ʵ�����Ʊ�SO2��ѧ����ʽ___��
��2��C�е�������___����ʵ��֤��SO2��___���塣
��3��D�еķ�Ӧ����֤��SO2��___�ԣ�F�е�������___��G��SO2���ˮ��Ӧ�ķ���ʽ��___��
��4��H�е��Լ�������������Һ���������ն���Ķ����������壬��ֹ��Ⱦ��������Ӧ�����ӷ���ʽΪ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com