
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.则下列说法中不正确的是

A.还原性:I->Fe2+>Br-
B.原混合溶液中FeBr2的物质的量为3mol
C.线段AB表示Fe2+被氯气氧化
D.原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3
【答案】C
【解析】
A、反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A正确;
B、通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B正确;
C、通入氯气后,碘离子先被氧化,线段AB即在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,表示I-被氯气氧化,故C错误;
D、通入氯气的量为1~3mol的过程中,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故D正确;
答案选C。


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】化学平衡常数![]() 、电离常数(Ka、Kb)、溶度积常数
、电离常数(Ka、Kb)、溶度积常数![]() 等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A. 当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)和溶度积常数![]() 一定均变大
一定均变大
B. ![]() 说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C. 向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生![]() 沉淀,则
沉淀,则![]()
D. 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵受热分解的反应方程式为![]()
![]()
![]() ,用
,用![]() 表示阿伏加德罗常数的值。下列说法不正确的是 ( )
表示阿伏加德罗常数的值。下列说法不正确的是 ( )
A. 1 L 0.1 mol·L1![]() 溶液中Fe2+的数目小于0.1
溶液中Fe2+的数目小于0.1![]()
B. 将1 mol ![]() 和1 mol
和1 mol ![]() 充分反应后,其分子总数为1.5
充分反应后,其分子总数为1.5![]()
C. 标准状况下,每生成15.68 L气体转移电子数目为0.8![]()
D. 常温常压下,3.0 g![]() 中含有的中子总数为1.6
中含有的中子总数为1.6![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
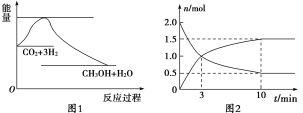
(1)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2 mol CO2和8 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) =________;
②该反应的平衡常数表达式K=________。
(2)830 ℃,反应的平衡常数K=1,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有________(填“A”“B”“C”或“D”)。
物质 | A | B | C | D |
n(CO2) | 3 | 1 | 3 | 1 |
n(H2) | 2 | 2 | 4 | 2 |
n(CH3OH) | 1 | 2 | 3 | 0.5 |
n(H2O) | 4 | 2 | 3 | 2 |
(3)25 ℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3 kJ的热量,写出该反应的热化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的高锰酸钾反应(不加热),来制取氯气。
反应:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)“双线桥法”标出电子转移情况________。
(2)若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
①理论上需要多少克KMnO4参加反应?________。
②被氧化的HCl的物质的量为多少?________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是__________(填“增大”“不变”或“减小”,以下相同)。
(2)将容器的体积缩小一半,其正反应速率__________,逆反应速率__________。
(3)保持体积不变,充入N2 使体系压强增大,其正反应速率__________,逆反应速率__________。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率__________,逆反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaAs晶体的熔点很高, 硬度很大, 密度为ρ g·cm-3,Ga 和As 的摩尔质量分别为MGag·mol-1和MAs g·mol-1, 原子半径分别为rGa pm 和rAs pm, 阿伏加德罗常数值为NA, 其晶胞结构如下图所示, 下列说法错误的是
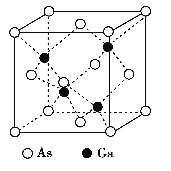
A. 该晶体为原子晶体
B. 在该晶体中,Ga和As均无孤对电子,Ga和As的配位数均为4
C. 原子的体积占晶胞体积的百分率为![]()
D. 所有原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:

(1)探究BaCO3和BaSO4之间的转化,实验操作:
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,__________
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是_______。
③实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______
(2)探究AgCl和AgI之间的转化,实验Ⅲ:
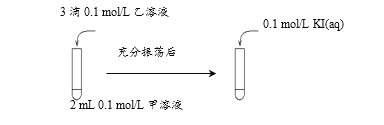
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。

注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是______(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是 _______________
③ 结合信息,解释实验Ⅳ中b<a的原因:______。
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com