
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
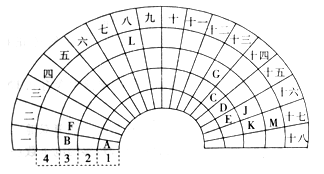
(1)元素C的最高价氧化物的电子式为____;元素G的离子结构示意图为____。
(2)元素L位于周期表的第_________族,1mol/L LM2溶液500mL与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_____性,原因是____________(用离子方程式表示)。
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的物质的量之比为1:3,则该反应的化学方程式为___________。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________。
【答案】![]()
![]() VIII 10Fe2++6Br- +8Cl2=10Fe3++3Br2+16Cl- 碱性 AlO2-+2H2O
VIII 10Fe2++6Br- +8Cl2=10Fe3++3Br2+16Cl- 碱性 AlO2-+2H2O![]() Al(OH)3+OH- Al2O3+3C+N2
Al(OH)3+OH- Al2O3+3C+N2![]() 2AlN+3CO SiO+2NaOH=Na2SiO3+H2↑
2AlN+3CO SiO+2NaOH=Na2SiO3+H2↑
【解析】
(1)根据示意图可判断元素C位于第二周期第14列,为碳元素,则其最高价氧化物是CO2,CO2属于共价化合物,电子式为![]() ;元素G位于第三周期第13列,为铝元素,则其离子结构示意图为
;元素G位于第三周期第13列,为铝元素,则其离子结构示意图为![]() 。
。
(2)元素L位于第四周期第8列,应该是铁元素,位于周期表的第四周期第VIII族;M位于第四周期第17列,M是溴元素,K位于第三周期第17列,K是氯元素,500mL1mol/L FeBr2溶液中溴化亚铁的物质的量是0.5mol,亚铁离子的还原性强于溴离子,氯气首先氧化亚铁离子,然后再氧化溴离子,则与0.5molFe2+反应的Cl2物质的量为0.25mol,剩余0.15molCl2消耗0.3molBr-,即参与反应的Fe2+、Br-、Cl2物质的量之比为0.5mol:0.3mol:0.4mol=5:3:4,则反应的离子方程式为10Fe2++6Br- +8Cl2=10Fe3++3Br2+16Cl-。
(3)根据示意图可判断B是Na,E是O,则化合物X是偏铝酸钠,在溶液中偏铝酸根水解溶液显碱性,水解的离子方程式为AlO2-+2H2O![]() Al(OH)3+OH-。
Al(OH)3+OH-。
(4)D是氮元素,和G组成的化合物为AlN,C是碳元素,工业上用氧化铝、碳单质和氮气在高温下制备AlN,其中氧化铝和碳单质的物质的量之比为1:3,这说明反应后生成的是CO,则该反应的化学方程式为Al2O3+3C+N2![]() 2AlN+3CO。
2AlN+3CO。
(5)隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠),说明硅元素的化合价升高,则化合价降低的应该是氢元素,即反应中还生成氢气,所以反应的化学方程式为SiO+2NaOH=Na2SiO3+H2↑。


科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,改变0.1 molL-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() (X)随pH的变化如图所示[已知]
(X)随pH的变化如图所示[已知]![]() (X)=
(X)=![]() 。下列叙述错误的是( )
。下列叙述错误的是( )
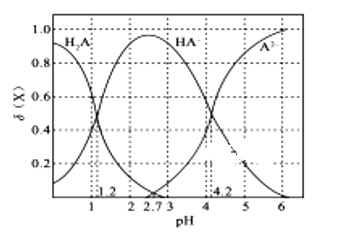
A.pH=1.2时, c(K+)+c(H+)=c(H2A) + c(OH-)+2c(A2-)
B.常温下,H2A的电离平衡常数Ka2 =10-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.KHA溶液中粒子浓度为c(K+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜能与浓硫酸在加热条件下反应,反应方程式为:
_____Cu +____H2SO4(浓) ![]() _____CuSO4 +____SO2↑+_____H2O
_____CuSO4 +____SO2↑+_____H2O
(1)配平上述方程式,并用双线桥法分析电子转移的方向和数目___________(在答题卷上的方程式中表示);
(2)该反应中还原剂为___________,氧化产物为__________;
(3)该反应中浓H2SO4体现____________性;
(4)还原剂与氧化剂的物质的量之比为______,标况下若生成SO2的体积为11.2 L,则反应时转移的电子为_______ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl为白色粉末,微溶于水,不溶于乙醇,潮湿的CuCl在空气中被氧化为Cu2(OH)3Cl。
(1)一种由海绵铜(Cu)为原料制备CuCl的工艺流程如下:

①“溶解”步骤发生反应的离子方程式为_________________________________;
②潮湿的CuCl在空气中被氧化的化学反应方程式为_________________________________;
③已知常温下Cu(OH)2溶度积常数Ksp=2×10-20要使c(Cu2+)=0.2 mol·L-1的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的千分之一)则应调节溶液pH为___________以上。
(2)次磷酸(H3PO2)是一元中强酸,可用于作金属表面处理剂。
①向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的化学方程式:_____________;
②H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。在该过程中,氧化剂与还原剂的物质的量之比为:___________;
③NaH2PO2的水溶液呈弱碱性,用离子方程式说明原因:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe(OH)SO4]n能用做净水剂(絮凝剂),可由绿矾(FeSO47H2O)和KClO3在水溶液中反应得到。下列说法不正确的是( )
A.KClO3作氧化剂,每生成1mol[Fe(OH)SO4]n消耗![]() molKClO3
molKClO3
B.生成聚合硫酸铁后,水溶液的pH增大
C.聚合硫酸铁可在水溶液中水解生成氢氧化铁胶体而净水
D.在反应中氧化剂和还原剂物质的量之比为1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:

下列有关判断不正确的是
A.甲的分子式为 C6H12
B.乙与环己二烯互为同系物
C.上述流程发生的反应类型有取代反应、消去反应、加成反应
D.环己二烯与溴水 1:1 反应可得 2 种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
A | 第3周期ⅣA族 |
B | 族序数是周期数的3倍 |
C | 原子序数是11 |
D | D3+与Ne的电子数相同 |
(1)A、B的元素符号分别为__、__,C、D的元素名称分别为__、__。
(2)写出B、C的常见单质在加热时的反应方程式:__。
(3)从原子结构的角度分析,A原子与B原子的__相同,C原子与D原子的__相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素形成的单质在环境、生命活动、生产、科研等方面有重要作用。
(1)氟利昂在紫外线的作用下能产生氯原子,氯原子对臭氧层有破坏作用。氯原子对臭氧层的破坏作用可用如下过程表示:Cl+O3![]() ClO+O2、O3
ClO+O2、O3![]() O2+O、ClO+O
O2+O、ClO+O![]() Cl+O2。这一过程总的化学方程式是______________________________。根据总反应的化学方程式,可知氯原子在反应中作________________________。
Cl+O2。这一过程总的化学方程式是______________________________。根据总反应的化学方程式,可知氯原子在反应中作________________________。
(2)意大利科学家使用普通氧分子和带正电的氧离子制出了新型的氧分子O4,它可能具有与S4相似的长方形结构。O4的摩尔质量为______;相同质量的O2、O3、O4的分子数之比为______,原子数之比为______;下列有关O4的说法不正确的是______(填序号)。
A.题述中生成O4的反应不属于化学变化
B.O4与O2、O3都是氧的同素异形体
C.O2可能具有很强的氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com