
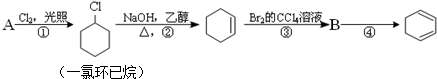
 ,①的反应类型是取代反应,③的反应类型是加成反应.反应④的化学方程式是
,①的反应类型是取代反应,③的反应类型是加成反应.反应④的化学方程式是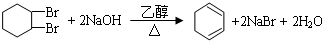
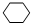
分析 由合成路线可知,反应①为光照条件下的取代反应,所以A为 ,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,则B为
,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,则B为 ,反应④为卤代烃的消去反应生成1,3-环己二烯,据此解答.
,反应④为卤代烃的消去反应生成1,3-环己二烯,据此解答.
解答 解:(1)由合成路线可知,反应①为光照条件下的取代反应,所以A为 ,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,则B为
,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,则B为 ,反应④为卤代烃的消去反应生成1,3-环己二烯,反应方程式为:
,反应④为卤代烃的消去反应生成1,3-环己二烯,反应方程式为: ,
,
故答案为: ;取代反应;加成反应;
;取代反应;加成反应; ;
;
(2)若该烃A的一种同分异构体B能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2,2-二甲基丁烷,则此烃结构简式为:CH2═CHC(CH3)3,名称是:3,3-二甲基-1-丁烯,核磁共振氢谱有3个吸收峰,其面积比是9:1:2,
与该烃B同类物质的同分异构体中,主链含有6个C原子时,碳碳双键有3种位置,即有3种同分异构体;
主链含有5个C原子,碳碳双键处于端位时,甲基有3种位置,碳碳双键处于2、3号碳原子上,甲基有3种位置,有6种同分异构体;
主链含有4个C原子,碳碳双键处于端位时,支链为乙基,只能处于2号碳原子上,支链为2个甲基,可以分别处于2、3号碳原子上,或都处于3号碳原子,有3种同分异构体,
故共有12种同分异构体,
故答案为:CH2═CHC(CH3)3;3,3-二甲基-1-丁烯;3;9:1:2;12.
点评 本题考查有机物的合成、有机反应类型、限制条件同分异构体书写,注意根据反应条件与有机物结构解答,掌握卤代烃的水解、消去反应,(2)中同分异构体说明判断为易错点.


科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L的NaHSO4溶液,PH=1 | B. | 0.1mol/L的H2SO4溶液,PH>1 | ||
| C. | 0.01mol/L的NaOH溶液,PH=10 | D. | pH=9的NaOH溶液稀释1000倍,PH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取a g混合物用酒精灯充分加热后质量减少bg | |
| B. | 取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收后质量增加bg | |
| C. | 取a g混合物于锥形瓶中加水溶解,滴入1~2滴甲基橙指示剂,用标准盐酸溶液滴定至终点,消耗盐酸VmL | |
| D. | 取a g混合物于锥形瓶中加水溶解,滴入1~2滴酚酞指示剂,用标准盐酸溶液滴定至终点,消耗盐酸VmL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 | |
| B. | 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 | |
| C. | 将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝熔点高于铝 | |
| D. | 将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量Ca(OH)2溶液反应,转移的电子数为NA | |
| B. | 1 mol碳烯(:CH2)所含的电子数目为6 NA | |
| C. | 常温常压下,11.2 L甲烷中含有的氢原子数小于2 NA | |
| D. | 某温度时,1 L pH=6的纯水中含OH-数为10-6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温条件下稀释氢氟酸时,HF的Ka增大,水的KW不变 | |
| B. | 向Mg(OH)2沉淀悬浊液中加入NH4Cl固体,c(Mg2+)、c(OH-)浓度均增大 | |
| C. | 0.1mol/LNaHCO3溶液中,c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 0.1mol/LNa2SO3溶液中,加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NH4NO3溶液中含有的氮原子数为0.2NA | |
| B. | 1 mol氯气分别与足量铁和铝完全反应时转移的电子数均为3NA | |
| C. | 16g O2和16g O3均含有NA个氧原子 | |
| D. | 25℃时1L pH=1的H2SO4溶液中含有H+的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
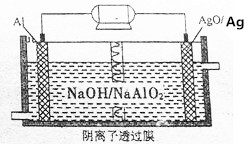 我国“蛟龙”号载入潜水器进行第五次下潜试验,最大深度达到7062米,并完全返回.其动力电源是Al-AgO电池,原理如图所示.下列说法中正确的是( )
我国“蛟龙”号载入潜水器进行第五次下潜试验,最大深度达到7062米,并完全返回.其动力电源是Al-AgO电池,原理如图所示.下列说法中正确的是( )| A. | Al电极是该电池的正极 | |
| B. | Ag在AgO/Ag电极上发生氧化反应 | |
| C. | 该电池负极反应是2Al-6e-+8OH-═2AlO2-+4H2O | |
| D. | AgO/Ag电极溶液中的pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com