
【题目】分某同学设计如下实验方案分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是_______________。
(2)试剂a是___________,试剂b是___________,固体B是___________。(填化学式)
(3)操作③的方法是_____________________________。
(4)加入试剂b所发生反应的化学方程式为___________________。
(5)该方案能否达到实验目的:__________若不能,应如何改进(若能,此题不用回答)_______________。
(6)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是___________的质量(填A、A1、B、C)。
【答案】(1)过滤;
(2)K2CO3、HCl、BaCl2
(3)向过滤器中加水至盖住固体,待水漏完,重复上述操作2-3次
(4)BaCO3+HCl=BaCl2+CO2![]() +H2O
+H2O
(5)不能;向操作②所得滤液中加入足量的HCl后,蒸发结晶得到KCl
(6)A1或B
【解析】试题分析:分离KCl和BaCl2两种固体混合物,先溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,则试剂a为K2CO3,过滤后沉淀加入盐酸可生成BaCl2溶液则试剂b为盐酸,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl。
(1)操作②是分离固体和液体的操作是过滤;故答案为:过滤;
(2)固体溶解后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,故答案为:K2CO3;HCl;BaCl2;
(3)操作③是洗涤沉淀,方法为向过滤器中加水至盖住固体,待水漏完,重复上述操作2-3次,故答案为:向过滤器中加水至盖住固体,待水漏完,重复上述操作2-3次;
(4)加入试剂b,BaCO3与HCl生成二氧化碳、水和氯化钡,其反应的方程式为BaCO3+HCl=BaCl2+CO2↑+H2O,故答案为:BaCO3+HCl=BaCl2+CO2↑+H2O;
(5)操作②所得滤液为KCl和K2CO3的混合物,直接蒸发结晶得不到纯净的KCl,所以不能得到实验目的;滤液中的杂质为K2CO3,在滤液中加入过量盐酸使K2CO3转化为KCl后再蒸发结晶;故答案为:不能;应在滤液中加入过量盐酸后再蒸发结晶;
(6)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,还要求出KCl和BaCl2二者之一的质量,沉淀A没有洗涤含有杂质离子不能用于求算氯化钡的质量,利用沉淀A的质量可以求出氯化钡的质量,固体B即是BaCl2,而固体C中的KCl部分来源于K2CO3,所以不能用C的质量求算;故答案为:A1或B。


科目:高中化学 来源: 题型:
【题目】下列关于化学电源的说法不正确的是( )
A.我们可以根据硫酸密度的大小来判断铅蓄电池是否需要充电
B.燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源
C.普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了
D.由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn作为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴如图是“×××”牌饮用矿泉水标签的部分内容。
××× (饮用矿泉水) 净含量:350mL 配料表:纯净水、硫酸镁、氯化钾 保质期:12个月 主要成分:钾离子(K+):1.0~27.3mg/L 镁离子(Mg2+):0.1~4.8mg/L 氯离子(Cl-):10~27.3mg/L 硫酸根离子(SO42-):0.4~19.5mg/L |
请认真阅读标签内容,计算:
①镁离子的物质的量浓度的最大值为_____________。
②一瓶合格的这种矿泉水中SO42-的物质的量不能超过_______ 。
⑵某物质A在一定条件下加热分解,产物都是气体,分解方程式为:2A![]() B↑+2C↑+2D↑。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为__________。
B↑+2C↑+2D↑。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
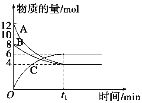
(1)反应的化学方程式为__________________。
(2)从开始到t1 min末时,用物质C表示的反应速率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阻燃剂氢氧化铝受热分解时吸收热量,同时生成耐高温的氧化铝和水蒸气,起到防火作用.下列关于该阻燃剂防火原因的分析中错误的是( )
A.氢氧化铝受热分解时吸收燃烧物表面的热量
B.氢氧化铝分解生成的水蒸气稀释燃烧物表面的氧气
C.氢氧化铝受热分解吸收热量使可燃物的着火点降低
D.氢氧化铝分解生成的氧化铝覆盖在燃烧物表面,使燃烧物与O2隔绝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,分别用氯化氢和四种混合气体吹出体积相等的五个气球。四个气球中,与氯化氢所含原子数可能相等的是( )。
A. Ar、NH3 B. O2、Ne C. H2 、CO2 D. N2、O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol·L-1Ba(OH)2溶液300mL,反应后溶液中SO42﹣的物质的量浓度为( )
A.0.4mol·L-1 B.0.3mol·L-1 C.0.2mol·L-1 D.0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH不稳定、易分解、在氯气中能燃烧,与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+= Cu2++Cu。根据以上信息回答:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是____________。
(2)写出CuH在氯气中燃烧的化学反应方程式________________________。
(3)CuH溶解在稀盐酸中生成的气体是______________,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是__________。
II:用高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,则化学反应方程式为__________________________。
(2) 有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是___________。
(3)某同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001 mol·L-1 AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是__________。
②已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.0×10-3mol·L-1。试计算此时溶液中Cl-的浓度是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com