
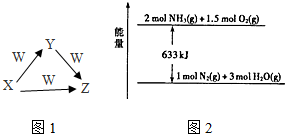
 X、Y、Z、W为中学化学常见的物质,它们之间的转化关系如图所示.请填写下列空白.
X、Y、Z、W为中学化学常见的物质,它们之间的转化关系如图所示.请填写下列空白. 3CO2+2Fe.(用化学方程式表示)
3CO2+2Fe.(用化学方程式表示)分析 根据题中各物质转化关系,Ⅰ.若X是酸式盐,Z是NH3,且常温下0.1mol/LX溶液pH≈1,则X为NH4HSO4,W为NaOH或KOH,Y为(NH4)2SO4;
Ⅱ.若X是酸,W是一种常见的金属单质,则W应有可变化合价,所以可推断得X为HNO3,W为Fe,Y为Fe(NO3)3,Z为Fe(NO3)2,据此答题.
解答 解:Ⅰ.若X是酸式盐,Z是NH3,且常温下0.1mol/LX溶液pH≈1,则X为NH4HSO4,W为NaOH或KOH,Y为(NH4)2SO4,
(1)X→Y的离子方程式是H++OH-=H2O,
故答案为:H++OH-=H2O;
(2)X为NH4HSO4,铵根离子发生水解,所以X溶液中各种离子浓度由大到小的顺序为c(H+)>c(NH4+)>c(SO42-)>c(OH-),
故答案为:c(H+)>c(NH4+)>c(SO42-)>c(OH-);
(3)820℃时,一定量NH3和O2反应生成NO和H2O,若该反应消耗0.20mol NH3,放出热量45.3kJ,该反应的热化学方程式为①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906kJ•mol-1,结合如图所示能量关系,可知NH3和O2反应生成N2和H2O的热化学方程式为②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266kJ•mol-1,根据盖斯定律可知,将$\frac{1}{2}$(①-②)可得N2与O2反应生成NO的热化学方程式为N2 (g)+O2 (g)=2NO(g)△H=+180 kJ•mol-1,
故答案为:N2 (g)+O2 (g)=2NO(g)△H=+180 kJ•mol-1;
Ⅱ.若X是酸,W是一种常见的金属单质,则W应有可变化合价,所以可推断得X为HNO3,W为Fe,Y为Fe(NO3)3,Z为Fe(NO3)2,
(4)Y→Z的离子方程式是 2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(5)工业上用一氧化碳冶炼金属铁,反应方程式为3CO+Fe2O3 3CO2+2Fe,
3CO2+2Fe,
故答案为:3CO+Fe2O3 3CO2+2Fe;
3CO2+2Fe;
(6)食品包装中常见的脱氧剂组成为Fe粉末、NaCl、炭粉等,其脱氧过程实质上发生了电化学腐蚀,该电化学腐蚀中,铁做原电池的负极,发生氧化反应,负极的电极反应式为Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
点评 本题考查元素化合物的性质,正确推断元素是解本题关键,难点是离子浓度大小的判断,根据电荷守恒来分析解答,难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 三种元素的原子序数 Y>X>Z | |
| B. | 三种元素的原子半径 X>Y>Z | |
| C. | 同周期元素中X的金属性最强 | |
| D. | 同周期元素中Z的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CH2+Br2→CH3CHBrCH2Br | |
| B. | CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2+H2O | |
| C. | CH3COOH+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| D. | C6H6+HNO3$→_{△}^{浓H_{2}SO_{4}}$C6H5NO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

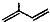 命名为2-甲基-1,3-丁二烯.
命名为2-甲基-1,3-丁二烯.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,温度高于150℃完全分解得到固体Y和固体Z的化学方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S;
,温度高于150℃完全分解得到固体Y和固体Z的化学方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与足量酸性高锰酸钾反应 | B. | 依次通入通入足量溴水和浓硫酸中 | ||
| C. | 在一定条件下通入H2 | D. | 分别进行燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com