
 钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.
钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.分析 (1)CO的燃烧热为283KJ•mol-1,则①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ/mol,②2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-825.5KJ•mol-1,根据盖斯定律来计算反应的焓变;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,根据三行式计算;
(3)提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析;
(4)比较压强,统一温度,在相同温度200℃时,A的转化率比B的高,说明压强改变,平衡正向移动;
(5)反应速率之比等于各物质计量数之比;
(6)不改变反应混合物用量的前提下,用温度、压强对化学平衡产生影响;
(7)燃料电池的负极通入燃料,失去电子发生氧化反应.
解答 解:(1)已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ/mol,②2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-825.5KJ•mol-1,①×3-②得到反应:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),该反应的△H=(-283kJ/mol)×3-(-825.5KJ•mol-1)=-23.5kJ/mol,
故答案为:-23.5kJ/mol;
(2)反应$\frac{1}{3}$Fe2O3(s)+CO(g)=Fe2O3(s)+CO2(g)的平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$,
$\frac{1}{3}$Fe2O3(s)+CO(g)=Fe2O3(s)+CO2(g)
初始浓度:0.1 0.1
变化浓度:0.06 0.18
平衡浓度:0.04 0.28
K=$\frac{0.28}{0.04}$=7,
故答案为:7;
(3)a、该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故A错误;
b、增加压强,平衡逆向移动,CO的平衡转化率减小,故b错误;
c、选取合适的催化剂,不影响平衡移动,CO的平衡转化率不变,故c错误;
d、及时吸收或移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;
故选d.
(4)比较压强,统一温度,在相同温度200℃时,A的转化率比B的高,说明压强改变,平衡正向移动,对于CO(g)+2H2(g)?CH3OH(g),是气体体积缩小的反应,则压强的改变只能是增大压强,所以A点的压强大,为5.0MPa,
故答案为:A;
(5)反应速率之比等于各物质计量数之比,达平衡时,v逆(CO)=v正(CH3OH)=$\frac{1}{2}$v正(H2),即v正(H2)=v逆(CO)+v正(CH3OH),在达平衡之前,正反应速率大于逆反应速率,即v正(CH3OH)>v逆(CO),故达平衡前v正(H2)>v逆(CO)+v正(CH3OH),
故答案为:>;
(6)不改变反应混合物用量的前提下,用温度、压强对化学平衡产生影响,从图中可知,升温CO的转化率降低,降温速率会减慢,所以选择增大压强,加快反应速率且平衡正向移动,提高CO的转化率,
故答案为:其他条件不变,增大压强;
(7)燃料电池的负极通入燃料,失去电子发生氧化反应,在碱性环境的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
点评 本题考查化学平衡的有关计算、化学反应焓变计算、平衡常数、电化学等有关知识,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.02mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(N2)=0.01mol/(L•min) | D. | v(H2)=0.015mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | X | Y | Z | M |
| A | O2 | CO2 | CO | C |
| B | CH3CH2OH | CH3CHO | CH3COOH | O2 |
| C | NaOH | NaHCO3 | Na2CO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯和聚乙烯完全燃烧生成的CO2分子数均为2NA | |
| B. | 25℃时,pH=3的1.0L NaHSO3溶液中,含Na+数目为0.001NA | |
| C. | 2.24LNH3中含共价键数目为0.3 NA | |
| D. | 78g苯含有C=C双键的数目为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为O2+2H2O+4e-=4OH- | |
| B. | 放电时正极发生氧化反应,外电路中电子从正极流向负极 | |
| C. | 负极反应为CH4+10OH--8e-=CO32-+7H2O | |
| D. | 随着放电的进行,溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
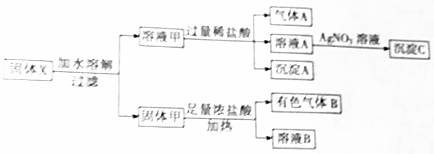
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
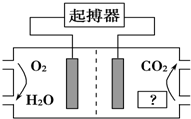 如图所示,最近美国医学家利用人体自身环境设计了心脏起搏器,其动力由人体体液中的能量物质提供.下列有关说法正确的是( )
如图所示,最近美国医学家利用人体自身环境设计了心脏起搏器,其动力由人体体液中的能量物质提供.下列有关说法正确的是( )| A. | 图中“?”为人体中的脂肪 | |
| B. | O2极为心脏起搏器的负极 | |
| C. | 产生的CO2使人体血液呈酸性,长期使用对人体有害 | |
| D. | 电池正极的电极反应式为O2+4H++4e-═2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com