
【题目】下列关于电解质溶液中离子关系的说法正确的是![]()
![]()
A. ![]() 溶液中离子浓度关系:
溶液中离子浓度关系:![]()
B. ![]() 和
和![]() 等体积混合后离子浓度关系:
等体积混合后离子浓度关系:![]()
C. 常温下,向醋酸钠溶液中滴加少量醋酸使溶液的![]() ,则混合溶液中:
,则混合溶液中:![]()
D. 常温下,在![]() 的溶液中,
的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存
能大量共存
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 1 mol Fe溶于过量硝酸,电子转移数为2NA
B. 2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
C. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
D. 0.1 mol 的11B中,含有0.6NA个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq) + 2I-(aq) + 2H+(aq) I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
反应ii:I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
(1)H2O2与S2O32-反应的热化学方程式为______。
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均为0.01 mol/L)。
a.向酸化的H2O2溶液中加入________溶液,溶液几秒后变为蓝色。
b._________,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为0.01 mol/L)
实验序号 | a | b | |
试 剂 | H2O2/mL | 5 | ______ |
H2SO4/mL | 4 | 2 | |
Na2S2O3/mL | 8 | _____ | |
KI(含淀粉)/mL | 3 | _____ | |
H2O | 0 | ______ | |
将上述溶液迅速混合 观察现象 | 溶液变蓝所需时间 为t1秒 | 溶液变蓝所需时间 为t2秒 | |
① 将实验b补充完整。
② 对比实验a和实验b,t1_____t2(填“>”或“<”)。
③ 结合(2)中现象解释溶液混合后一段时间才变蓝的原因________。
④ 利用实验a的数据,计算t1时间内H2O2与S2O32-反应的平均反应速率(用H2O2浓度的变化表示)________mol/(L·s)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质加入水中或与水发生反应后,溶液温度降低的是( )
A. 生石灰与水反应 B. 氢氧化钠固体加入水中
C. 浓硫酸加入水中 D. 硝酸铵晶体加入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从经济效益和环境保护的观点出发,由铜制取硝酸铜最适宜的方法是
A. Cu与浓HNO3―→Cu(NO3)2
B. Cu与稀HNO3―→Cu(NO3)2
C. Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D. Cu+AgNO3―→Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中,正确的是![]()
![]()
A. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B. ![]() 和
和![]() 溶液等体积混合后:
溶液等体积混合后:![]()
C. 物质的量浓度相等的![]() 和NaHS混合溶液中:
和NaHS混合溶液中:![]()
D. 同浓度的下列溶液中,![]() 、
、![]() 、
、![]() 、
、![]() ;
;![]() 由大到小的顺序是:
由大到小的顺序是:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图3-4-2所示。下列说法错误的是( )
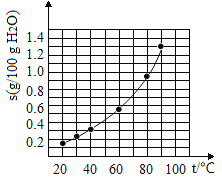
A. 溴酸银的溶解是放热过程
B. 温度升高时溴酸银的溶解速率加快
C. 60℃时溴酸银的Ksp约等于6×10-4
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为 ( )
Si(s)+4HCl(g),该反应的反应热△H为 ( )
A. +412 kJ·mol-1 B. -412 kJ·mol-1
C. +236 kJ·mol-1 D. -236 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com