
【题目】某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq) + 2I-(aq) + 2H+(aq) I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
反应ii:I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
(1)H2O2与S2O32-反应的热化学方程式为______。
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均为0.01 mol/L)。
a.向酸化的H2O2溶液中加入________溶液,溶液几秒后变为蓝色。
b._________,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为0.01 mol/L)
实验序号 | a | b | |
试 剂 | H2O2/mL | 5 | ______ |
H2SO4/mL | 4 | 2 | |
Na2S2O3/mL | 8 | _____ | |
KI(含淀粉)/mL | 3 | _____ | |
H2O | 0 | ______ | |
将上述溶液迅速混合 观察现象 | 溶液变蓝所需时间 为t1秒 | 溶液变蓝所需时间 为t2秒 | |
① 将实验b补充完整。
② 对比实验a和实验b,t1_____t2(填“>”或“<”)。
③ 结合(2)中现象解释溶液混合后一段时间才变蓝的原因________。
④ 利用实验a的数据,计算t1时间内H2O2与S2O32-反应的平均反应速率(用H2O2浓度的变化表示)________mol/(L·s)。
【答案】H2O2(aq)+2S2O32-(aq)+2H+(aq)=S4O62-(aq)+2H2O(l) △H=-1269.1kJ/mol 淀粉碘化钾 向a中所得蓝色溶液中加入硫代硫酸钠溶液 5 8 3 2 < 反应ⅰ慢,反应ⅱ快,反应ⅰ生成的I2立即与S2O32-反应,直至S2O32-被消耗尽,再生成的I2才能使淀粉变蓝,因此溶液混合一段时间后才变蓝 ![]() mol/(Ls)
mol/(Ls)
【解析】
(1)已知反应i:H2O2(aq) + 2I-(aq) + 2H+(aq) I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
反应ii:I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
根据盖斯定律,由i+ii得反应H2O2(aq)+2S2O32-(aq)+2H+(aq)=S4O62-(aq)+2H2O(l) △H=ΔH1+ΔH2=-1269.1kJ/mol,故H2O2与S2O32-反应的热化学方程式为H2O2(aq)+2S2O32-(aq)+2H+(aq)=S4O62-(aq)+2H2O(l) △H=-1269.1kJ/mol;
(2)a.向酸化的H2O2溶液中加入淀粉碘化钾溶液,碘离子被氧化生成碘单质使淀粉变蓝,故溶液几秒后变为蓝色;
b.向a中所得蓝色溶液中加入硫代硫酸钠溶液,碘被还原生成碘离子,溶液立即褪色;
(3)探究c(H+)对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为0.01 mol/L),为使探究时每次只改变一个条件,所加溶液总体积必须相等,故:
① 将实验b补充完整,分别为5、8、3、2;
②对比实验a和实验b,实验a中 c(H+)较大,浓度越大化学反应速率越大,故t1<t2;
③反应ⅰ慢,反应ⅱ快,反应ⅰ生成的I2立即与S2O32-反应,直至S2O32-被消耗尽,再生成的I2才能使淀粉变蓝,因此溶液混合一段时间后才变蓝;
④ 利用实验a的数据,用H2O2浓度的变化表示t1时间内H2O2与S2O32-反应的平均反应速率为![]() mol/(L·s)。
mol/(L·s)。


科目:高中化学 来源: 题型:
【题目】某有机物的结构式为 ,它在一定条件下能发生的反应有( )
,它在一定条件下能发生的反应有( )
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A. ②③④ B. ①③⑤⑥ C. ①③④⑤ D. ②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molH2(g)中H-H键需要吸收436kJ能量,根据能量变化示意图,下列说法或热化学方程式不正确的是( )

A. 断开1molHCl(g)中H-Cl键要吸收432kJ能量
B. 生成1molCl2(g)中的Cl-Cl键放出243kJ能量
C. HCl(g)→1/2H2(g)+1/2Cl2(g)-92.5kJ
D. H2(g)+Cl2(g)→2HCl(g)+864kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为原子序数依次增大的5种短周期元素。A是最轻的金属,B的最低负化合价的绝对值比最高正化合价少2,C的简单阴离子C2-与氖原子有相同的电子层结构,D与A同主族,E的M层电子数比L层少2个。
(1)写出元素符号:A______、C______,E在元素周期表中的位置是________________;
(2)C、D、E原子半径由大到小:______(写元素符号,后同),C、D、E简单离子的半径由大到小_____;
(3)A常用作电池的电极材料,含A的电池通常采用非水电解质或固体电解质,原因是______(用化学方程式解释);
(4)B与氢元素可以形成10电子微粒X和18电子微粒Y,Y是一种良好的火箭燃料。X中含有的共价键类型是_______,Y的电子式为_________;
(5)C的两种单质在常温下都是气体,它们互为____________。比较C的氢化物和E的氢化物沸点:C___E(填“>”“<”或“=”),原因是____________
(6)用电子式表示D与E的二元化合物的形成过程:________________,碳原子与E能形成AB2型化合物,请写出该物质的电子式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产、生活中下列过程不涉及氧化还原反应的是 ( )
A.多吃水果(富含维生素C)美容养颜B.铝的表面生成致密的氧化薄膜
C.久置于空气中,浓硫酸的体积增大D.食品袋内装有还原铁粉的小袋防食品变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液中离子关系的说法正确的是![]()
![]()
A. ![]() 溶液中离子浓度关系:
溶液中离子浓度关系:![]()
B. ![]() 和
和![]() 等体积混合后离子浓度关系:
等体积混合后离子浓度关系:![]()
C. 常温下,向醋酸钠溶液中滴加少量醋酸使溶液的![]() ,则混合溶液中:
,则混合溶液中:![]()
D. 常温下,在![]() 的溶液中,
的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存
能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺是一种重要的中枢神经传导物质,用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受。多巴胺可用香兰素与硝基甲烷等为原料按下列路线合成。
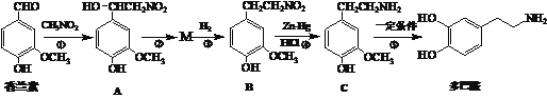
(1)香兰素中的含氧官能团的名称是_________________。(写两种)
(2)反应①、④的反应类型分别为__________、___________。
(3)写出由A→M的化学方程式_______________________________。
(4)写出同时满足下列条件的香兰素的一种同分异构体的结构简式___________。
①能与碳酸氢钠溶液反应 ②能与FeCl3溶液发生显色反应 ③有5种不同化学环境的氢原子
(5)苯乙胺(![]() )是生物体中重要的生物碱。写出用苯甲醇、硝基甲烷(CH3NO2)为原料制备苯乙胺的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: _____________
)是生物体中重要的生物碱。写出用苯甲醇、硝基甲烷(CH3NO2)为原料制备苯乙胺的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: _____________
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com