
【题目】已知A、B、C均为含铁化合物,请根据以下四种物质的转化过程回答相关问题:
![]()
(1)反应①、②、③中属于氧化还原反应的是_______(填序号);
(2)向B的溶液中滴入几滴KSCN溶液后.可观察到的现象是______________________
(3)C的化学式为____________:
(4)写出反应②的离子方程式__________;
(5)选择合适的试剂也可以实现B转化为A,请写出利用你选的试剂实现该转化的化学方程式________________________________。
【答案】 ①② 溶液变红色 Fe(OH)3 2 Fe2++Cl2 =2 Fe3+ +2 Cl— 2FeCl3+Fe=3FeCl2 或者2FeCl3+Cu=2FeCl2+CuCl2
【解析】(1)反应①是铁与盐酸反应生成氯化亚铁和氢气,铁元素、氢元素化合价发生变化属于氧化还原反应、反应②是氯化亚铁与氯气反应生成氯化铁,铁元素、氯元素化合价发生变化属于氧化还原反应、反应③是氯化铁与氢氧化钠反应生成氢氧化铁和氯化钠,反应中各元素化合价均不变不属于氧化还原反应,故属于氧化还原反应的是①②;(2)B溶液中含有氯化铁,向B的溶液中滴入几滴KSCN溶液后.可观察到的现象是溶液变红色;(3)C为氢氧化铁,其化学式为Fe(OH)3;(4)反应②是氯化亚铁与氯气反应生成氯化铁,反应的离子方程式为2 Fe2++Cl2 =2 Fe3+ +2Cl—;(5)利用铁或铜等将氯化铁还原为氯化亚铁,可以实现B转化为A,实现该转化的化学方程式有2FeCl3+Fe=3FeCl2 或者2FeCl3+Cu=2FeCl2+CuCl2。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列联系实际的说法正确的是( )
A. 高梁、玉米等植物的种子经发酵、蒸馏得到的“绿色能源”是甲烷
B. 人类目前直接利用的能量大部分是由化学反应产生的
C. 煤、石油、天然气都是可再生能源
D. 硫和碳的氧化物是形成酸雨的主要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)(氟只有两种价态:-1,0)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O![]() 2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
A. NF3是氧化剂,H2O是还原剂
B. 若1mol NF3被氧化,反应转移电子数为2NA
C. 若生成0.4molHNO3,则转移0.4mol电子
D. 氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明非金属性:Cl____S(填“>”或“<”),反应的离子方程式为_______。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律。

(3)仪器A的名称为___________,干燥管D的作用为___________________。
(4)若要证明非金属性:Cl>I,C中为淀粉—碘化钾混合溶液,B中装有KMnO4固体,则A中试剂为___________,观察到C中溶液____________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液。观察到C中溶液 ________(填现象),即可证明。但有的同学认为盐酸具有挥发性,HCl可进入C中干扰实验,应在两装置间添加装有 _________溶液的洗气瓶除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同一元素各核素的质量数不同,但它们的化学性质几乎完全相同
B. 任何元素的原子都是由核外电子和核内中子、质子构成的
C. 钠原子失去一个电子后变成了氖原子
D. ![]() 、
、![]() 、
、![]() 的质量数相同,所以它们互为同位素
的质量数相同,所以它们互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定某补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)步骤②中加入足量NaOH发生的主要反应的离子方程式为 ,
步骤③中反应的化学方程式为 。
(2)步骤④中一系列处理的操作步骤: 、洗涤、 、冷却、称量。
(3)若实验中需用98%的浓硫酸(密度为1.84g/mL)配制1 mol/L的稀硫酸480 mL。配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有 ,需用量筒量取该浓硫酸 mL。
(4)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
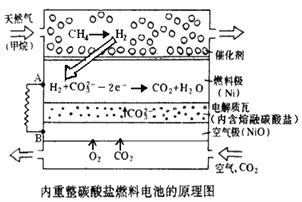
(1)外电路电子流动方向:由_____流向_____(填字母)。
(2)正极发生反应的离子方程式是_______________________________________________.
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e 转移,有_______ g 精铜析出。
(4)25℃时,用石墨电极电解2.0L 0.25 mol·L-1 CuSO4溶液,5min后在一个电极上有6.4gCu析出。则阳极的电极反应式为____________________; 此时溶液的pH=________(溶液体积变化忽略不计)。
(5)已知常温下Fe(OH)3的溶度积Ksp=1.0×10-38,通常认为残留在溶液中的离子浓度小于 1.0×10-5 mol·L-1时就认为沉淀完全,若使CuCl2溶液中的Fe3+完全沉淀溶液的pH应为_________;加入物质A以调节溶液pH至所需值,A的化学式可以是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,科学家新研制的一种酸性乙醇电池(用磺酸类质子作溶剂),比甲醇电池效率高出32倍,电池反应式为C2H5OH+3O2=== 2CO2+3H2O,电池构造如下图所示:
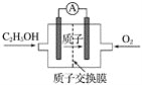
下列关于该电池的说法不正确的是( )
A. 通入乙醇的一极为负极
B. 正极反应式为4H++O2+4e-===2H2O
C. 负极反应式为C2H5OH-12e-+3H2O===2CO2+12H+
D. 随着反应的进行,溶液的酸性保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com