
分析 (1)氯化铝是共价化合物,熔融固体不能电离出阴阳离子;
(2)碳棒做电极电解熔融氧化铝,阳极上氧离子失电子发生氧化反应生成氧气,氧气和碳反应生成二氧化碳,消耗电极需要定期补充;
(3)若在空气中加热MgCl2•6H2O,可生成Mg(OH)Cl或MgO,依据原子守恒书写化学方程式;
(4)惰性电极电解熔融MgCl2制备镁,阳极上是氯离子失电子生成氯气,阴极是镁离子得到电子生成金属镁.
解答 解:(1)工业上冶炼金属铝则是采用惰性电极电解熔融Al2O3的方法,不采用电解熔融AlCl3的方法是因为氯化铝是共价化合物,固体熔融会升华,不能得到阴阳离子,不能发生电解反应得到金属铝,氯化铝溶于水完全电离属于电解质,故答案为:C;
(2)碳棒做电极电解熔融氧化铝,阳极上氧离子失电子发生氧化反应生成氧气,电极反应为:2O2--4e-=O2,在冶炼过程中,阳极材料碳被氧气氧化成一氧化碳,反应为C+O2$\frac{\underline{\;高温\;}}{\;}$CO2或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO,所以需定期地进行更换,
故答案为:2O2--4e-=O2,C+O2$\frac{\underline{\;高温\;}}{\;}$CO2或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO;
(3)若在空气中加热MgCl2•6H2O,可生成Mg(OH)Cl或MgO,依据原子守恒书写化学方程式为:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H2O↑;氯化镁水解显酸性,氯化氢气流中加热防止水解,HCl气流可抑制Mg2+水解;
故答案为:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H2O↑;HCl;
(4)惰性电极电解熔融MgCl2制备镁,阳极上是氯离子失电子生成氯气电极反应为2Cl--2e-=Cl2↑,阴极是镁离子得到电子生成金属镁,阴极电极反应为:Mg2++2e-═Mg,
故答案为:Mg2++2e-═Mg.
点评 本题考查了常见化合物性质、电解原理、盐类水解应用,注意基础知识的熟练掌握,题目难度不大.


科目:高中化学 来源: 题型:多选题
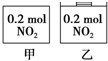 甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )| A. | 平衡时各容器内c(NO2)的大小顺序为乙>甲 | |
| B. | 平衡时N2O4的百分含量:乙>甲 | |
| C. | 平衡时甲中的压强与乙中的压强:甲>乙 | |
| D. | 平衡时混合物的平均相对分子质量:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| B. | 机动车实行限行措施是减少雾霾的途径之一 | |
| C. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈黄色的溶液:Na+、Ba2+、AlO2-、Cl- | |
| B. | 由水电离得到的c(H+)=1×10-12的溶液中:K+、Na+、CH3COO-、Br- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、Cl-、NO3- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:$NH_4^+$、Al3+、$NO_3^-$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7个 | B. | 9个 | C. | 19个 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| B. | 实验室常采用铁屑、溴水、苯混合制溴苯 | |
| C. | 苯中含有少量的苯酚可先加适量的浓溴水,使之生成三溴苯酚,再过滤除去 | |
| D. | 一定物质的量浓度溶液的配置必须要用干燥的容量瓶,否则有误差 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com