
下列叙述正确的是( )
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C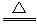 CO2↑+2H2O+2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
CO2↑+2H2O+2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)

将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
| 选用的仪器(填字母) | 加入的试剂 | 作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对某酸性溶液(可能含有Br-、SO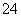 、H2SO3、NH
、H2SO3、NH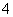 )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在溶液中是否存在的是( )
A.Br- B.SO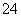 C.H2SO3 D.NH
C.H2SO3 D.NH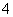
查看答案和解析>>
科目:高中化学 来源: 题型:
酸碱中和滴定常用于测定酸碱溶液的浓度。
(1)实验中,在正式测定前,常常用已知浓度的酸(或碱)滴定已知浓度的碱(或酸),测定滴定曲线,然后选择合适的指示剂指示滴定终点,以保证数据的准确性。如:用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.1 mol·L-1醋酸(CH3COOH)溶液,有关数据记录如下表:
|
| 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
①根据上表数据在下图中绘制0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.1 mol·L-1醋酸(CH3COOH)溶液的滴定曲线。
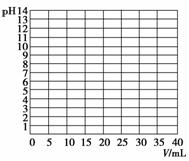
②根据你所绘制的曲线,确定pH的突变范围是______。
③下列指示剂中适合于本实验的是________。
A.甲基橙 B.石蕊 C.酚酞
(2)用酸式滴定管准确量取0.1 mol·L-1的醋酸溶液。在调节酸式滴定管的起始读数时,要使滴定管的尖嘴部分充满醋酸,如果滴定管内部有气泡,赶走气泡的操作是________。
(3)滴定过程中,眼睛应重点观察________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
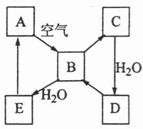
(1)写出A在加热条件下与H2反应的化学方程式
(2)写出E与A的氢化物反应生成A的化学方程式
(3)写出一个由D生成B的化学方程式 ;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10mol·L-1的NaOH溶液混合。
①写出反应的离子方程式 ;
②反应后溶液的pH 7(填“大于”、“小于”或“等于”),理由是 ;
③加热反应后的溶液,其pH (填 “增大”、“不变”或“减小”),理由是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
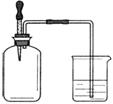
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④
C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:
 ;
;
(2)写出“联合制碱法”有关反应的化学方程式:
;
;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
 ;
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为____________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是_________________________。
装置C中的烧瓶需要加热,其目的是_____________________________________。
②反应一段时间后,装置D中观察到的现象是______________________________________,装置D不能采用普通玻璃管的原因是____________________________________,装置D中发生反应的化学方程式为__________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及______________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_________________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com