
酸碱中和滴定常用于测定酸碱溶液的浓度。
(1)实验中,在正式测定前,常常用已知浓度的酸(或碱)滴定已知浓度的碱(或酸),测定滴定曲线,然后选择合适的指示剂指示滴定终点,以保证数据的准确性。如:用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.1 mol·L-1醋酸(CH3COOH)溶液,有关数据记录如下表:
|
| 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
①根据上表数据在下图中绘制0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.1 mol·L-1醋酸(CH3COOH)溶液的滴定曲线。
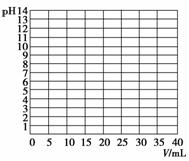
②根据你所绘制的曲线,确定pH的突变范围是______。
③下列指示剂中适合于本实验的是________。
A.甲基橙 B.石蕊 C.酚酞
(2)用酸式滴定管准确量取0.1 mol·L-1的醋酸溶液。在调节酸式滴定管的起始读数时,要使滴定管的尖嘴部分充满醋酸,如果滴定管内部有气泡,赶走气泡的操作是________。
(3)滴定过程中,眼睛应重点观察________。
科目:高中化学 来源: 题型:
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:
4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是:
A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.酸性(水溶液):HSCN > H2CO3 > HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,PhCH2N3可用于合成化合物Ⅴ(见下图,仅列出部分反应条件,Ph-代表苯基 )。
)。
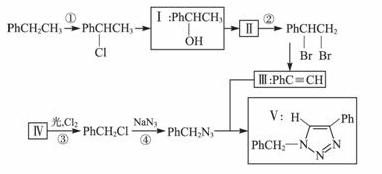
(1)下列说法不正确的是_____________(填字母)。
A.反应①④属于取代反应
B.化合物Ⅰ可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ 能生成化合物Ⅰ
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为_______________(不要求写出反应条件)。
(3)反应③的化学方程式为__________________(要求写出反应条件)。
(4)化合物Ⅲ与PhCH2N3发生环加成反应生成化合物Ⅴ,不同条件下环加成反应还可生成化合物Ⅴ的同分异构体。该同分异构体的分子式为______________,结构式为___________。
(5)科学家曾预言可合成C(N3)4,其可分解成单质,用作炸药。有人通过NaN3与NCCCl3反应成功合成了该物质。下列说法正确的是_____________________(填字母)。
A.该合成反应可能是取代反应
B.C(N3)4与甲烷具有类似的空间结构
C.C(N3)4不可能与化合物Ⅲ发生环加成反应
D.C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4 C+6N2↑
C+6N2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
利用组成物质的原子、离子或分子的一些特征性质,检验组成化学物质的元素,是研究物质组成的常用方法。下列叙述不正确的是( )
A.仅根据在火焰上燃烧产生的气味,不能确定毛线是“真羊毛”还是“人造羊毛”
B.用红外光谱仪确定物质中是否存在某些有机原子团
C.用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素
D.用原子吸收光谱确定物质中含有哪些金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
用括号中的试剂和方法除去各组物质中的少量杂质,正确的是( )
A.苯中的甲苯(酸化高锰酸钾溶液 分液)
B.乙醇中的水(无水硫酸铜 干燥)
C.乙醇中的乙酸(NaOH溶液 分液)
D.溴乙烷中的乙醇(水 分液)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
查看答案和解析>>
科目:高中化学 来源: 题型:
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
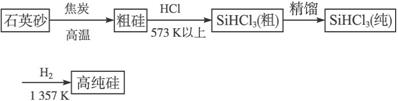
①写出由纯SiHCl3制备高纯硅的化学反应方程式____________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇 水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式_________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_________________________。
水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式_________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_________________________。
(2)下列有关硅材料的说法正确的是__________________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释__________________________ _____。
_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
四川有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
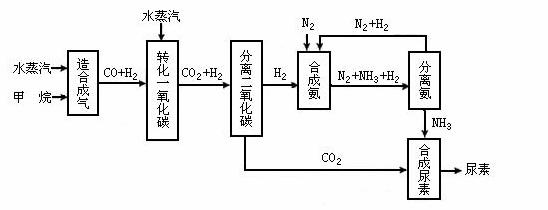
请填写下列空白:
(1)已知0.5 mol甲烷与0.5 mol水蒸汽在t ℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是: 。
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气,请运用化学反应速率和化学平衡的观点说明采取该措施的理由: 。
(3)当甲烷合成氨气的转化率为75%时,以5.60×107 L甲烷为原料能够合成: L氨气。(假设体积均在标准状况下测定)
(4)已知尿素的结构简式为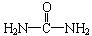 请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
① ;② 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com