
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:
4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是:
A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.酸性(水溶液):HSCN > H2CO3 > HCN
科目:高中化学 来源: 题型:
下列混合物的除杂方法与发生反应的类型均正确的是
| 混合物 | 加入试剂或方法 | 反应类型 | |
| A | 除去O2中的CO | 通入炽热的CuO中 | 化合反应 |
| B | 除去CO2中的HCl | 通入饱和NaHCO3溶液中 | 中和反应 |
| C | 除去CaCO3中的Na2CO3 | 溶解、加入BaCl2溶液 | 复分解反应 |
| D | 除去NaCl中的Na2CO3 | 加入适量盐酸、蒸发 | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应:TiCl4+4Na==4NaCl+Ti,下列说法正确的是 ( )
A.该反应说明钠是强还原剂,可用于冶炼金属
B.该反应条件是TiCl4在熔融状态或水溶液中
C.Ti是氧化产物 D.TiCl4是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
| ①中的物质 | ②中的物质 |
| |
| A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氨水 | 红纸条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
己知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O
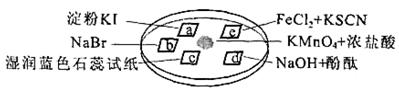
对实验现象的“解释或结论”正确的是
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+ > Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)下图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+ S=Na2
S=Na2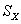 ,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
(3)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液PH
(填“增大”“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是( )
①幕布的着火点升高 ②幕布的质量增加 ③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
酸碱中和滴定常用于测定酸碱溶液的浓度。
(1)实验中,在正式测定前,常常用已知浓度的酸(或碱)滴定已知浓度的碱(或酸),测定滴定曲线,然后选择合适的指示剂指示滴定终点,以保证数据的准确性。如:用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.1 mol·L-1醋酸(CH3COOH)溶液,有关数据记录如下表:
|
| 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
①根据上表数据在下图中绘制0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.1 mol·L-1醋酸(CH3COOH)溶液的滴定曲线。
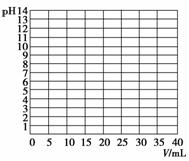
②根据你所绘制的曲线,确定pH的突变范围是______。
③下列指示剂中适合于本实验的是________。
A.甲基橙 B.石蕊 C.酚酞
(2)用酸式滴定管准确量取0.1 mol·L-1的醋酸溶液。在调节酸式滴定管的起始读数时,要使滴定管的尖嘴部分充满醋酸,如果滴定管内部有气泡,赶走气泡的操作是________。
(3)滴定过程中,眼睛应重点观察________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com