
 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑, 2NaOH+H2↑+Cl2↑,阴极,还原,2H2O+2e-=H2 +2OH-↑,阳极,氧化,2Cl--2e-=Cl2↑;
2NaOH+H2↑+Cl2↑,阴极,还原,2H2O+2e-=H2 +2OH-↑,阳极,氧化,2Cl--2e-=Cl2↑; 2NaOH+H2↑+Cl2↑转移电子
2NaOH+H2↑+Cl2↑转移电子 2NaOH+H2↑+Cl2↑转移电子
2NaOH+H2↑+Cl2↑转移电子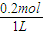 =0.2mol/L;
=0.2mol/L; 2NaOH+H2↑+Cl2↑转移电子
2NaOH+H2↑+Cl2↑转移电子 =1.138g/cm3,
=1.138g/cm3,

科目:高中化学 来源: 题型:阅读理解
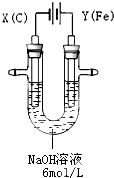 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.| 充电 | 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
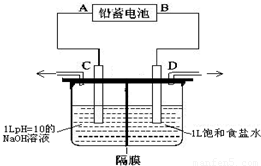
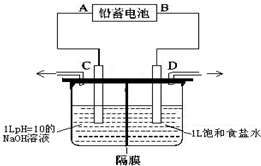
 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,山东省大力发展以太阳能、风能为代表的新能源。试完成下列问题。
(1)现在电瓶车所用电池一般为铅蓄电池,如图所示,这是一种典型的可充电电池,电池总反应式为:![]() 。
。
则电池放电时,溶液的![]() 会 (填“增大”或“减小”),写出负极反应式为
会 (填“增大”或“减小”),写出负极反应式为
,充电时,铅蓄电池的负极应与充电器电源的 极相连。

(2)为体现节能减排的理念,中国研制出了新型燃料电池汽车,该车装有“绿色心
脏”一一质子交换膜燃料电池。下图是某种质子交换膜燃料电池原理示意图。该电
池的正极是 (填“a”或“b”,下同)极,工作过程中,质子(H+)透过质子
交换膜移动到 极。写出该电池的负极反应式为:
。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com