
| A. | NaCl、NaBr、KI三种无色溶液 | |
| B. | HCl、NaCl、NaNO3、Na2CO3四种溶液 | |
| C. | NaBr、KCl、HCl三种溶液 | |
| D. | 淀粉、淀粉碘化钾、KI、溴水四种溶液 |
分析 A.三种试剂均无色,相互之间不反应;
B.不能鉴别NaCl、NaNO3;
C.三种试剂均无色,相互之间不反应;
D.溴水为橙色,与KI反应生成紫色碘溶液,溴水与淀粉KI溶液反应后溶液变蓝.
解答 解:A.三种试剂均无色,相互之间不反应,不用任何试剂不能鉴别,故A错误;
B.不能鉴别NaCl、NaNO3,不用任何试剂不能鉴别,故B错误;
C.三种试剂均无色,相互之间不反应,不用任何试剂不能鉴别,故C错误;
D.溴水为橙色,与KI反应生成紫色碘溶液,溴水与淀粉KI溶液反应后溶液变蓝,不用任何试剂即可鉴别,故D正确;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 升高温度 | D. | 加入少量氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
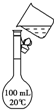 用18mol/L的浓硫酸配制150.00mL 1.00mol/L硫酸:
用18mol/L的浓硫酸配制150.00mL 1.00mol/L硫酸:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
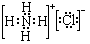 ;②B溶于水的过程中存在的可逆反应式为NH3+H2O
;②B溶于水的过程中存在的可逆反应式为NH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com