
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C��NO��10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C��CO��10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
���� ��1�����ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ�����ʵ���ϵ�����мӼ�����Ŀ���Ȼ�ѧ����ʽ����Ӧ��Ҳ������Ӧ�ļ��㣻
��2���ɱ������ݿ�֪4sʱ��Ӧ����ƽ�⣬1-3s��NOŨ�ȱ仯��Ϊ4.5��10-4 mol/L-1.5��10-4 mol/L=3��10-4 mol/L����2s��ƽ��ÿ���ڱ仯��Ϊ1.5��10-4 mol/L���淴Ӧ���У���Ӧ���ʼ�С����2s��ǰ1s��NOŨ�ȱ仯��Ӧ����1.5��10-4 mol/L����2sʱNO��Ũ��С��4.5��10-4 mol/L-1.5��10-4 mol/L=3��10-4 mol/L����2sʱNO��Ũ��Ӧ����1.5��10-4 mol/L��3��10-4 mol/L֮�䣻
��3��ʵ����ں�ʵ������¶���ͬ��ƽ�ⳣ����ͬ����������ʽ���м�����⣻
��4���ٷ�Ӧ2CO��g��+4H2��g��?CH3OCH3��g��+H2O��g���У�������Ũ��Խ��CO��ת����Խ��
����ͼ���֪�������¶ȣ�CO��ת���ʽ��ͣ�˵��ƽ�������ƶ���
��5����CO����������Ӧ��O2-�������CO32-��
��������������ʧ���ӣ������������ӵõ��ӣ�
��� �⣺��1����֪����2 NO��g��+2CO��g��?2CO2��g��+N2��g����H=-746.5KJ/mol
��2C ��s��+O2��g��?2CO��g����H=-221.0KJ/mol
��C ��s��+O2��g��?CO2��g����H=-393.5KJ/mol
�����ݸ�˹���ɣ��ۡ�2-��-�ٵõ���N2��g��+O2��g��=2NO��g�� ���H=��-393.5KJ/mol����2-��-220KJ/mol��-��-746.5KJ/mol��=+180.5KJ/mol��
�ʴ�Ϊ��+180.5 kJ•mol-1��
��2���ɱ������ݿ�֪4sʱ��Ӧ����ƽ�⣬1-3s��NOŨ�ȱ仯��Ϊ4.5��10-4 mol/L-1.5��10-4 mol/L=3��10-4 mol/L����2s��ƽ��ÿ���ڱ仯��Ϊ1.5��10-4 mol/L���淴Ӧ���У���Ӧ���ʼ�С����2s��ǰ1s��NOŨ�ȱ仯��Ӧ����1.5��10-4 mol/L����2sʱNO��Ũ��С��4.5��10-4 mol/L-1.5��10-4 mol/L=3��10-4 mol/L����2sʱNO��Ũ��Ӧ����1.5��10-4 mol/L��3��10-4 mol/L֮�䣬ѡ����ֻ��2.5��10-4 mol/L���ϣ�
��ѡD��
��3��H2O��g��+CO��g��?CO2��g��+H2��g��
��ʼ 0.5mol/L 1mol/L 0 0
ת�� 0.2mol/L 0.2mol/l 0.2mol/L 0.2mol/L
ƽ��0.3mol/L 0.8mol/L 0.2mol/L 0.2mol/L
H2O��g��+CO��g��?CO2��g��+H2��g��
��ʼ 1mol/L 0.5mol/L 0 0
ת�� ��0.5-$\frac{c}{2}$��mol/L ��0.5-$\frac{c}{2}$��mol/l $\frac{d}{2}$mol/L $\frac{d}{2}$mol/L
ƽ�⣨0.5+$\frac{c}{2}$��mol/L $\frac{c}{2}$mol/L $\frac{d}{2}$mol/L $\frac{d}{2}$mol/L
����0.5-$\frac{c}{2}$=$\frac{d}{2}$
��d=1-c����ƽ�ⳣ����ȿ�֪��$\frac{\frac{1-c}{2}��\frac{1-c}{2}}{��0.5+\frac{c}{2}����\frac{c}{2}}=\frac{0.2��0.2}{0.3��0.8}$����֮��c=0.6������H2O��g����ת����Ϊ��$\frac{0.2}{0.5}��100%$=40%��ʵ�������CO��ת���ʵ�$\frac{0.5-\frac{0.6}{2}}{0.5}$=40%��
�ʴ�Ϊ��0.6��=��
��4���ٷ�Ӧ2CO��g��+4H2��g��?CH3OCH3��g��+H2O��g���У�������Ũ��Խ��CO��ת����Խ����a��b��c���ʴ�Ϊ��a��b��c��
����ͼ���֪�������¶ȣ�CO��ת���ʽ��ͣ�˵��ƽ�������ƶ���������ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ��Ͷ�ϱ���ͬ���¶�Խ��CO��ת����Խ�ͣ�ƽ�������ƶ����Ƶø÷�ӦΪ���ȷ�Ӧ��
��5���ٸ���CO����������Ӧ��O2-�������CO32-�������缫��ӦʽΪ��CO+2O2--2e-=CO32-��
�ʴ�Ϊ��CO+2O2--2e-=CO32-��
��������������ʧ���ӣ������������ӵõ��ӣ����Ե��0.1mol/L KCl��Һ�������ܷ�Ӧ�����ӷ���ʽΪ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+2OH-������ͼ֪��KOH��Һ��pH=13�������£�KOH��Ũ����0.1mol/L����n��KOH��=0.1mol/L��2L=0.2mol������2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$2OH-+H2��+Cl2��֪������0.2mol����������ת�Ƶ��ӵ����ʵ���=$\frac{0.2mol}{2}$��2=0.2mol��ȼ�ϵ�صĸ�����Ӧ����ʽ��CO+2O2--2e-=CO32-������1molCOת�Ƶ�����=2mol����˵�ת��0.2mol����ʱ����CO�����ʵ���Ϊ0.1mol����CO������=0.1mol��28g/mol=2.8g��
�ʴ�Ϊ��2.8g��
���� ���⿼���Ϊ�ۺϣ��漰��˹���ɵ�Ӧ�ã���ѧƽ�ⳣ���ļ��㼰Ӧ�ã�Ϊ��Ƶ���㣬������ѧ���ķ��������������Ŀ��飬����ʱע��Ӱ��ƽ���ƶ��������Լ�ƽ�ⳣ�����йؼ��㣬��Ŀ�Ѷ��еȣ�


 ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д� �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaCl��NaBr��KI������ɫ��Һ | |
| B�� | HCl��NaCl��NaNO3��Na2CO3������Һ | |
| C�� | NaBr��KCl��HCl������Һ | |
| D�� | ���ۡ����۵⻯�ء�KI����ˮ������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ܻۢ�Ϊͬ���칹�� | |
| B�� | �ڢܻۢ�Ϊͬϵ�� | |
| C�� | ����������������ʹ����KMnO4��Һ��ɫ��ֻ�Тڢۢ� | |
| D�� | �������ʷֱ�������H2�����ӳɷ�Ӧ�����ɵ�2�ֲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ�ϡ���������Ӧ�õ��������߿Ƽ�����λ������A��B�ĵ���ȼ��ʱ���ų������ȣ�������ȼ�ϣ���֪A��BΪ������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
�������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ�ϡ���������Ӧ�õ��������߿Ƽ�����λ������A��B�ĵ���ȼ��ʱ���ų������ȣ�������ȼ�ϣ���֪A��BΪ������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��| ������/��kJ•mol-1�� | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ���������Ǿֲ�����ҩ����������������ֹʹ������ʹ�ȣ���ṹ��ʽ����ͼ�������й��ڱ��������������ȷ���ǣ�������
���������Ǿֲ�����ҩ����������������ֹʹ������ʹ�ȣ���ṹ��ʽ����ͼ�������й��ڱ��������������ȷ���ǣ�������| A�� | ����ʽΪC9H10NO2 | |
| B�� | ��������2��ȡ�������Һ��������ı��������ͬ���칹����9�� | |
| C�� | 1 mol�û����������4 mol���������ӳɷ�Ӧ | |
| D�� | �����н�����ת���������ķ�ӦΪ������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
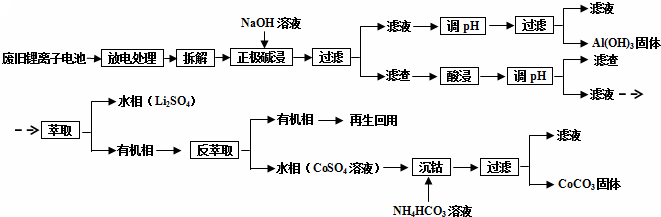
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ʱ��/min �¶�/�� | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | 0.5 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�2.24L�Ҵ�����������C-H����Ϊ0.5NA | |
| B�� | 3.2��O2��O3�Ļ�����к��е���ԭ����ĿΪ0.2NA | |
| C�� | 0.1mol•L-1��Al2��SO4��3��Һ�У�AL3+����ĿС��0.2NA | |
| D�� | 0.1molFe�μ�������ԭ��Ӧ��ת�Ƶĵ�����Ŀһ����0.3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬŨ�ȵ�������Һ����NH4Cl �ڣ�NH4��2SO4 ��NH4HSO4 ��NH4Al��SO4��2��Һ��c��NH4+��Ũ�ȵĴ�С��ϵ���ڣ��ܣ��ۣ��� | |
| B�� | һ��Ũ�ȵ�NaHS��Һ�У�c��Na+��+c��OH-��=c��H+��+c��HS-��+2c��H2S�� | |
| C�� | ��0.1 mol/L NH4Cl��ҺpH=5������������Ũ���������С�IJ�ֵΪ��0.1-10-5��mol/L | |
| D�� | ����������Һ����pH=4��H2SO4��Һ ��pH=4��NH4Cl��Һ ��pH=10�İ�ˮ ��pH=10��CH3COONa��Һ������ˮ�������������Ũ�ȴ�С��ϵΪ����=�ܣ��ۣ��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com