
 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B的单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B的单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
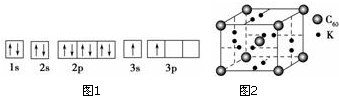
分析 (1)由图1电子轨道排布图可知,3s能级未填满就填充3p能级,3s能级能量比3p能级低,违背了能量最低原理;
(2)BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化;
(3)C60是分子晶体,金刚石是原子晶体,决定二者熔沸点的作用力不同;
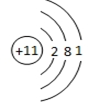
(4)钾元素位于第四周期ⅠA族,据此写出钾元素价电子排布式;利用均摊法确定K原子和C60分子的个数比;
(5)根据电负性递变规律判断电负性大小;根据价电子对互斥理论确定微粒的理论模型;每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,即形成三条共价键外,还形成一条π键,据此判断π键的数目.
解答 解:(1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,所以违背能量最低原理,
故答案为:能量最低原理;
(2)BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,
故答案为:sp杂化;
(3)C60是分子晶体,金刚石是原子晶体,决定二者熔沸点的作用力不同,C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键
,所以认为C60的熔点高于金刚石是错误的,
故答案为:否; C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键;
(4)钾元素位于第四周期ⅠA族,写出钾元素价电子排布式为4S1;该晶胞中C60个数=1+8×$\frac{1}{8}$=2,6×2×$\frac{1}{2}$=6,所以K原子和C60分子的个数比为6:2=3:1,
故答案为:4S1;3:1;
(5)电负性同周期从左到右,逐渐增大,同主族从上到下,逐渐减小,则电负性由大到小顺序为:N>C>Si;
NCl3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{5-3×1}{2}$=4,所以原子杂化方式是sp3,价层电子对互斥理论模型为为正四面体构型;
Si60分子中,共价键数目为60×3×$\frac{1}{2}$=90,每三条共价键含有一条π键,数目为:90×$\frac{1}{3}$=30,
故答案为:N>C>Si;正四面体;30.
点评 本题考查了位置、结构和性质的关系,题目难度中等,涉及晶胞的计算、电子排布图、杂化类型判断、电负性等知识点,试题知识点较多,充分考查了学生灵活应用基础知识的能力,要求学生能够运用均摊法计算化学键、晶胞的化学式.


科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

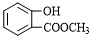 .
.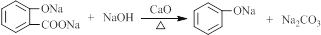 .
.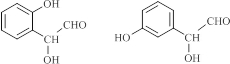 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.
.固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤通过物理变化液化后再作为能源,可减少PM2.5引起的危害 | |
| B. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| C. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| D. | 氟氯烃是安全、环保的制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
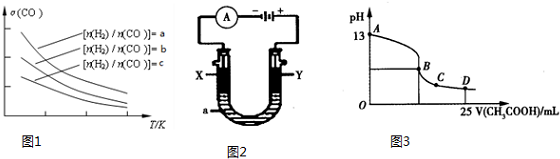
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液显弱酸性 | |
| B. | 该溶液中K+、Al3+、H+、SO${\;}_{4}^{2-}$可以大量共存 | |
| C. | 加水稀释该溶液,溶液中$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| D. | 向该溶液中加入足量的氢氧化钙溶液的离子方程式为:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com