
某研究性学习小组拟取盐湖苦卤的浓缩液(富含Ca2+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的无水CaCl2及液溴,他们设计了如下流程: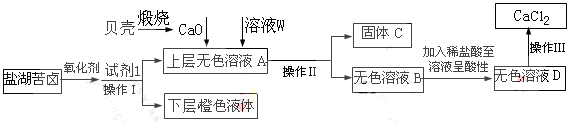
回答以下问题:
(1)操作Ⅰ中加入的试剂1是 ;在从橙色液体中分离出溴时,可能会导致收集到的产品中混有低沸点杂质的装置(见图A、B、C、D)是 。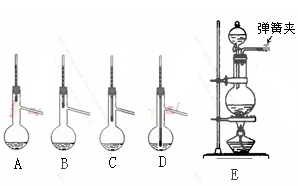
(2)加入溶液W的目的是 。
(3)操作Ⅲ所用的仪器除三脚架、酒精灯,还需要 。
(4)某同学用如上图E所示的实验装置制取操作1前的氧化剂,写出该反应的离子方程式 ,试简述该装置气密性的检验方法 。
(1)四氯化碳(或CCl4);CD(2)除去溶液中SO42-; (3)蒸发皿、玻璃棒
(4)MnO2+4H++2Cl- Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
法一:打开弹簧夹,关闭分液漏斗活塞,将导管外接导气管,并将导气管末端插入水槽中,用手握住圆底烧瓶(或用酒精灯对其进行微热),在导气管末端有气泡产生,在松开手(或撤离酒精灯)以后,导气管末端有一段水柱上升且一段时间内不下降,则证明该装置的气密性良好。
法二:关闭弹簧夹,打开分液漏斗的活塞,向烧瓶中不断加水,若一段时间后水不再流下,说明装置气密性良好。
解析试题分析:(1)盐卤中首先加入氯水将溴化物氧化为溴单质,再加入四氯化碳作萃取剂将溴单质从水中萃取出来,再根据液态溴单质沸点与四氯化碳不同,采用蒸馏法进行分离。蒸馏时温度计的水银球应该在支管口附近,若在液面下或位置太低就会收集到低沸点的馏分。
(2)为防止产生硫酸钙沉淀,应先加入氯化钡溶液使硫酸根离子发生反应产生硫酸钡沉淀,来除去硫酸根离子。贝壳的主要成分是碳酸钙,煅烧分解得到氧化钙,将其加入其上层清液中发生反应产生氢氧化钙,镁离子转化成氢氧化镁沉淀,过滤除去,用氯化钙溶液加热蒸发得到氯化钙晶体,在把晶体在氯化氢的氛围中加热蒸干届可制取得到无水氯化钙。操作Ⅲ蒸发所用的仪器除三脚架、酒精灯,还需要蒸发皿、玻璃棒。
(4)氯气在实验室中式用二氧化锰与浓盐酸加热制取的,反应的离子方程式是:MnO2+4H++2Cl- Mn2++2H2O+Cl2↑。检验装置气密性的方法可以是关闭弹簧夹,打开分液漏斗的活塞,向烧瓶中不断加水,若一段时间后水不再流下,说明装置气密性良好。也可采用其他方法。
Mn2++2H2O+Cl2↑。检验装置气密性的方法可以是关闭弹簧夹,打开分液漏斗的活塞,向烧瓶中不断加水,若一段时间后水不再流下,说明装置气密性良好。也可采用其他方法。
考点:考查混合物的分离、装置气密性检查、氯气的制法、杂质的除去等的知识。


科目:高中化学 来源: 题型:实验题
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。
某兴趣小组用如图所示装置进行Mg与SO2反应的实验。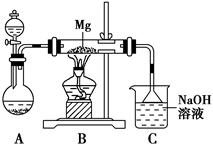
(1)选择制取SO2的合适试剂________(填编号)。
①浓HCl ②浓H2SO4 ③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是________________________________________,装置C中NaOH溶液的作用是___________________________________________________________
(3)甲同学推测Mg与SO2的反应和Mg与CO2的反应相似,则该反应方程式为_________________________________________;
乙同学的推测是:2Mg+3SO2 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2 2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀。
限选试剂:2 mol·L-1盐酸、2 mol·L-1硝酸、蒸馏水、2 mol·L-1 NaOH溶液、品红溶液、澄清石灰水、2 mol·L-1 CuSO4溶液;仪器和用品自选。
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后所得固体于试管中 | |
| ② | 向试管中的固体慢慢滴加____________,试管口塞上带导管的单孔塞,并将导管通入盛有________的试管中 | 若试管中的________,则丙同学推测正确,若试管中的固体未完全溶解,且________,则乙同学推测正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I- 能被NO3- 氧化成IO3-,被H2O2或O2等氧化为I2;② IO3- 能被HSO3- 还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3- 中的哪一种。
限选试剂如下:1.0 mol?L-1HNO3溶液、1.0 mol?L-1H2SO4溶液、1.0 mol?L-1NaHSO3溶液、3%H2O2溶液、1%淀粉溶液、蒸馏水。
(1)提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
(2)设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表:
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液,振荡 | 若溶液显 (填颜色),则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ;否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下: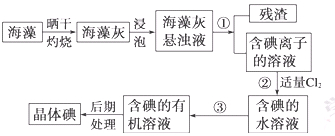
(1)指出操作③的名称: ;操作②中充入适量Cl2的目的是 。
(2)提取碘的过程中,可供选择的试剂是 ( )
| A.酒精 | B.四氯化碳 | C.汽油 | D.醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物。(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。请回答下列问题: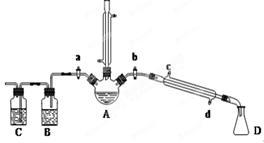
(1)仪器D的名称是 。
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。写出该反应的化学方程式 。
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等。熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是 、 。
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为 ,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气。
(5)相关有机物的数据如下:
| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
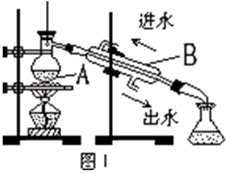
海洋生物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘: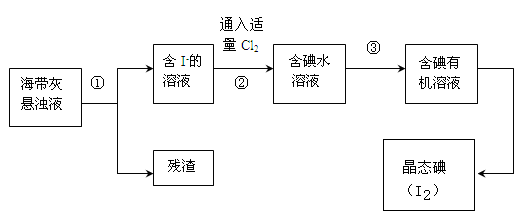
(1)指出提取碘的过程中有关的实验操作名称:①_________,③________。
(2)过程②中充入适量Cl2反应的离子方程式为_____________________。
(3)操作③中所用的有机试剂可以是___________(只填一种),简述选择其理由__________________。
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察下图所示实验装置,指出其错误之处并加以改正_______________________________________________________。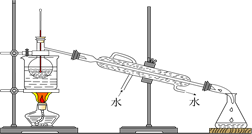
(5)进行上述蒸馏操作时,使用水浴的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)判断BaCl2已过量的方法是 。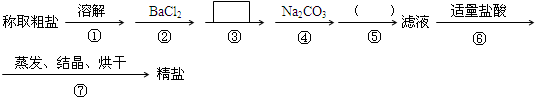
(2)第④步中,写出相应的离子方程式: ; ____________________________.
(3)在 中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
(4)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。)原因是:_______________________ _______ _________________;
步骤③和④可否颠倒____________。
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1)试剂X的化学式 。A中制取Cl2的离子方程式 。
(2)试剂Y的名称为 。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
| 步骤2:向A试管中滴加BaCl2溶液 | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2?6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图: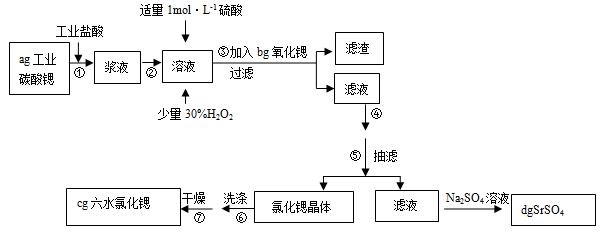
请回答:
(1)加入少量30%H2O2的作用 (用离子方程式表示);
(2)步骤③中氧化锶粉末的作用是 ,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 ;
(3)步骤④进行的实验操作为 、 ,步骤⑥中,洗涤氯化锶晶体最好选用 ;
| A.水 | B.硫酸 | C.氢氧化钠溶液 | D.氯化锶饱和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com