
【题目】氢氧燃料电池用于航天飞船,电极反应产生的水,经冷凝后可作为航天员的饮用水,其电极反应如下:①2H2+4OH﹣-4e﹣=4H2O,②O2+2H2O+4e﹣=4OH﹣ 当得到1.8L饮用水时,电池内转移的电子数约为( )
A.1.8mol
B.3.6mol
C.100mol
D.200mol
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.物质发生化学变化不一定都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.伴有能量变化的物质变化都是化学变化
D.即使没有物质的变化,也可能有能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨苄青霉素是高效、广谱和低毒的抗生素,其结构简式如图所示.下列说法不正确的是( ) 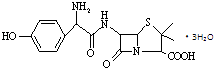
A.羟氨苄青霉素在空气中不能稳定存在
B.每个羟氨苄青霉素分子中含有3个手性碳原子
C.羟氨苄青霉素既能与盐酸反应,又能与碳酸氢钠溶液反应
D.1mol羟氨苄青霉素与氢氧化钠溶液反应时,最多消耗4molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉. Ⅰ.废液组成:
金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
浓度(gL﹣1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
Ⅱ.处理方案:
(1)步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2. 此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是 .
(2)步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤. ①Mn2+反应生成MnO2同时放出CO2 , 写出此反应的离子方程式: .
②Co2+反应生成Co(OH)3沉淀同时放出CO2 , 写出此反应的离子方程式:;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式: .
③此步骤中必须控制好NaClO溶液的用量,其原因可能是 .
(3)步骤3:回收镍 以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是: .
②电解的最佳pH范围是:(填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不属于氧化还原反应的是( )
A.3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O
B.3Cl2+6KOH=5KCl+KClO3+3H2O
C.3CCl4+K2Cr2O7=2CrO2Cl2+3COCl2+2KCl
D.2KMnO4 ![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
(1)已知:N2(g)+2H2(g)=N2H4(l)△H=+50.6kJmol﹣12H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=kJmol﹣1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 .
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 .
(2)采矿废液中的CN﹣ 可用H2O2处理.已知:H2SO4=H++HSO4﹣ HSO4﹣H++SO42﹣用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82﹣ , S2O82﹣水解可以得到H2O2 . 写出阳极上的电极反应式 .
(3)氧化镁处理含NH4+的废水会发生如下反应: MgO+H2OMg(OH)2 Mg(OH)2+2NH4+Mg2++2NH3H2O.
①温度对氮处理率的影响如图所示.在25℃前,升高
温度氮去除率增大的原因是 .
②剩余的氧化镁,不会对废水形成二次污染,理由是 .
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下: ①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL
②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热
③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]
④将吸收液移至锥形瓶中,加入2滴指示剂,用c molL﹣1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL.
则水样中氮的含量是mgL﹣1(用含c、V的表达式表示).(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
(1)已知:N2(g)+2H2(g)=N2H4(l)△H=+50.6kJmol﹣12H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=kJmol﹣1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 .
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 .
(2)采矿废液中的CN﹣ 可用H2O2处理.已知:H2SO4=H++HSO4﹣ HSO4﹣H++SO42﹣用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82﹣ , S2O82﹣水解可以得到H2O2 . 写出阳极上的电极反应式 .
(3)氧化镁处理含NH4+的废水会发生如下反应: MgO+H2OMg(OH)2 Mg(OH)2+2NH4+Mg2++2NH3H2O.
①温度对氮处理率的影响如图所示.在25℃前,升高
温度氮去除率增大的原因是 .
②剩余的氧化镁,不会对废水形成二次污染,理由是 .
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下: ①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL
②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热
③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]
④将吸收液移至锥形瓶中,加入2滴指示剂,用c molL﹣1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL.
则水样中氮的含量是mgL﹣1(用含c、V的表达式表示).(请写出计算过程)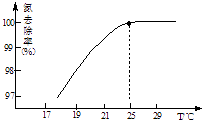
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol·L-1的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A. 950 mL,111.2 g B. 500 mL,117.0 g
C. 1 000 mL,117.0 g D. 任意规格,111.2 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com