

| A. | 氢化物的沸点R>X | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的稳定性:X>Y | |
| D. | X、Z形成的化合物中可能含有共价键 |
分析 这几种元素都是短周期元素,根据原子最外层电子数与原子序数关系知,X、Y、Z、R、W分别是O、F、Na、S、Cl元素,
A.R、X分别是S、O元素,氢化物的熔沸点与其相对分子质量成正比,但含有氢键的氢化物熔沸点较高;
B.W、R、X分别是Cl、S、O元素,原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.X、Z分别是O、Na元素,二者形成的化合物有Na2O、Na2O2.
解答 解:这几种元素都是短周期元素,根据原子最外层电子数与原子序数关系知,X、Y、Z、R、W分别是O、F、Na、S、Cl元素,
A.R、X分别是S、O元素,氢化物的熔沸点与其相对分子质量成正比,但含有氢键的氢化物熔沸点较高,硫化氢中只含共价键和分子间作用力,水中还含有氢键,氢化物的沸点:R<X,故A错误;
B.W、R、X分别是Cl、S、O元素,原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,S、Cl原子电子层数相同且原子序数S<Cl,所以原子半径S>Cl,O原子电子层数小于S、Cl,所以原子半径R>W>X,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性Y>X,则氢化物的稳定性Y>X,故C错误;
D.X、Z分别是O、Na元素,二者形成的化合物有Na2O、Na2O2,氧化钠只含离子键、过氧化钠中含有离子键和共价键,故D正确;
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析推断及判断能力,明确原子结构、元素周期表结构、物质结构及元素周期律是解本题关键,注意氢化物的稳定性与化学键有关,氢化物的熔沸点与分子间作用力有关,题目难度不大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:推断题
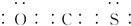 .
. HSO3-+OH-;溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
HSO3-+OH-;溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).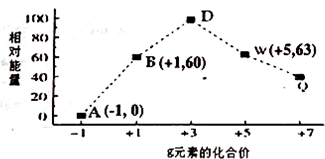
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)=2HCl(g);△H=-a $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H=-b | |
| B. | C(s)+$\frac{1}{2}$O2(g)=CO (g);△H=-a C(s)+O2(g)=CO2 (g);△H=-b | |
| C. | 2H2(g)+O2(g)=2H2O(l);△H=-a 2H2(g)+O2(g)=2H2O(g);△H=-b | |
| D. | S(g)+O2(g)=SO2 (g);△H=-a S(s)+O2(g)=SO2 (g);△H=-b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
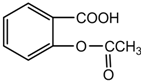 如图乙酰水杨酸又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用.对此化合 物不正确的说法是( )
如图乙酰水杨酸又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用.对此化合 物不正确的说法是( )| A. | 阿斯匹林的化学式为C9H8O4 | |
| B. | 该化合物具有酸性,能与 NaOH 或 NaHCO3反应 | |
| C. | 1 mol 该化合物与足量的 NaOH溶液反应,消耗 NaOH最大的物质的量为2 mol | |
| D. | 纯净的 Aspirin 不能与 FeCl3溶液反应,但它的水解产物能使FeCl3溶液显色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能用手直接接触药品 | B. | 可用酒精灯对烧杯直接加热 | ||
| C. | 用鼻孔凑到容器口去闻气体的气味 | D. | 尝一下实验室里酒精的味道 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | N2的电子式: | |
| C. | S2-的结构示意图: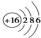 | |
| D. | 丙醛的结构简式:CH3CH2COH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 和Cu(NO3)2 | B. | Cu(NO3)2和Fe(NO3)2 | C. | AgNO3 和Fe(NO3)2 | D. | Fe(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 维生素A能发生取代、加成、酯化反应 | |
| B. | 维生素A不能与金属钠反应产生氢气 | |
| C. | 维生素A不能使酸性KMnO4溶液褪色 | |
| D. | 维生素A属于不饱和烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com