
| A. | H2(g)+Cl2(g)=2HCl(g);△H=-a $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H=-b | |
| B. | C(s)+$\frac{1}{2}$O2(g)=CO (g);△H=-a C(s)+O2(g)=CO2 (g);△H=-b | |
| C. | 2H2(g)+O2(g)=2H2O(l);△H=-a 2H2(g)+O2(g)=2H2O(g);△H=-b | |
| D. | S(g)+O2(g)=SO2 (g);△H=-a S(s)+O2(g)=SO2 (g);△H=-b |
分析 A.热化学方程式中,物质的量越多,伴随的能量变化越大,则前者放出热量大于后者;
B.一氧化碳是碳单质不完全燃烧的产物,完全燃烧时生成二氧化碳,完全燃烧放热更多;
C.液态水变为气态水的过程要吸收能量,则前者放出热量大于后者;
D.固体硫燃烧时要先变为气态硫,过程吸热,则前者放出热量大于后者.
解答 解:A.反应的能量变化和反应中各物质的量成正比,故b=$\frac{1}{2}$a,即b<a,故A错误;
B.可以很容易地判断出来第一个是不完全燃烧反应,第二个是完全燃烧反应,那么放出的热量很明显是完全燃烧比不完全燃烧放出的多,所以b>a,故B正确;
C.两个反应时都是氢气和氧气生成水,但第一个式子是生成气体,第二个是液态,从气态变为液态还要放出一定的热量,所以a>b,故C错误;
D.固体硫燃烧时要先变为气态硫,过程吸热,气体与气体反应生成气体比固体和气体反应生气气体产生热量多,则b<a,故D错误.
故选B.
点评 本题考查反应热大小比较,题目难度不大,明确反应热大小与物质状态及物质的量的关系即可解答,注意掌握热化学方程式的书写原则及表示意义,试题侧重考查学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1mol任何气体所占的体积为22.4L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH(CH3)CH(CH3)OH:3-甲基-2-戊醇 | |
| B. | CH3CH(CH3)CH═CH2:3-甲基丁烯 | |
| C. | CH3CH2C(CH3)2CH3:2,2-甲基丁烷 | |
| D. | CH2Cl-CH2Cl:二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难氧化,易加成,难取代 | |
| B. | 能氧化,难加成,易取代 | |
| C. | 易氧化,易加成,难取代 | |
| D. | 因是单双键交替结构,故易加成为环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;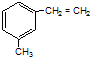 的名称为间甲基苯乙烯(3-甲基苯乙烯).
的名称为间甲基苯乙烯(3-甲基苯乙烯).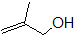 的分子式为:C4H8O.
的分子式为:C4H8O.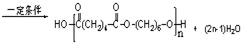 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氢化物的沸点R>X | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的稳定性:X>Y | |
| D. | X、Z形成的化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2O(l)═2H2(g)+O2(g)△H=+571.6KJ•mol-1,无法求H2的燃烧热 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,无法比较二者的稳定性 | |
| C. | 已知500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放出19.3KJ的热量,无法推出该反应的热化学方程式 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,无法得出△H2>△H1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com