
下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1mol任何气体所占的体积为22.4L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2?Ca2++2OH- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2SO3?2H++SO32- | D. | BaSO4═Ba2++SO42- |
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
下列关于溶液和胶体的叙述,正确的是( )
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
下列实验可行的是
A.用澄清石灰水检验CO中含有的CO2
B.用BaCl2除去NaOH溶液中混有的少量Na2SO4
C.用KSCN溶液检验溶液中含有的Fe2+
D.用溶解、过滤的方法分离CaCl2和NaCl固体混合物
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:实验题
Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。

已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是_____________。
(2)吸收塔中的原料B可以选用____________(填字母序号)。
a.NaCl溶液 b.Na2CO3溶液 c.Na2SO4溶液
b.Na2CO3溶液 c.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。
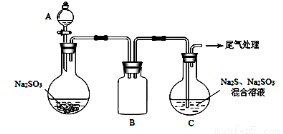
①A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是______________。装置B的作用是___________________。
②C中制备Na2S2O3发生的连续反应有:Na2S +H2O +SO2=Na2SO3 +H2S、____________和__________。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
有五组同族元素的物质,在101.3kPa时测定它们的沸点( )如下表所示:
)如下表所示:
① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr151.7 |
② | F2-187.0 | Cl2-33.6 | (b)58.7 | I2184.0 |
③ | (c)19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
④ | H2O100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
对应表中内容,下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第④组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
C.第②组物质均有氧化性;第③组物质对应水溶液均是强酸
D.上表中同族物质对应的氢化物的沸点,均随相对分子质量的增大而升高
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
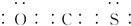 .
. HSO3-+OH-;溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
HSO3-+OH-;溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).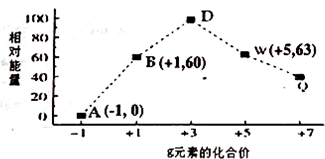
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)=2HCl(g);△H=-a $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H=-b | |
| B. | C(s)+$\frac{1}{2}$O2(g)=CO (g);△H=-a C(s)+O2(g)=CO2 (g);△H=-b | |
| C. | 2H2(g)+O2(g)=2H2O(l);△H=-a 2H2(g)+O2(g)=2H2O(g);△H=-b | |
| D. | S(g)+O2(g)=SO2 (g);△H=-a S(s)+O2(g)=SO2 (g);△H=-b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com