
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 23g Na与氧气充分燃烧,转移的电子数为NA
B. 1mol甲醇中含有的共价键数为4NA
C. 46g NO2和N2O4的混合气体含有的原子数为2NA
D. 标准状况下,22.4L氨水含有NH3分子数为NA
【答案】A
【解析】23g Na物质的量是1mol,与氧气充分燃烧,钠元素化合价由0→+1,所以转移的电子物质的量为1mol,即转移的电子数为NA,故A正确;B项,甲醇结构式是: ,所以1mol甲醇中含有的共价键数为5NA,故B错误;C项,如果46g完全是NO2,则NO2的物质的量是46g÷46gmol-1=1mol,因为一个分子中含有3个原子,所以1molNO2含有的原子的物质的量是3mol,数目是3NA,如果46g完全是N2O4,则N2O4的物质的量为46g÷92 gmol-1=0.5mol,一个分子中含有6个原子,所以46g的N2O4含有原子的物质的量是3mol,其数目为3NA,因此,无论是46g的NO2,还是46g的N2O4,还是46g的NO2和N2O4混合气体中含有原子总数均为3NA,故C项错误;D项,标准状况下,氨水不是气体,无法用气体摩尔体积计算,故D错误。综上,选A。
,所以1mol甲醇中含有的共价键数为5NA,故B错误;C项,如果46g完全是NO2,则NO2的物质的量是46g÷46gmol-1=1mol,因为一个分子中含有3个原子,所以1molNO2含有的原子的物质的量是3mol,数目是3NA,如果46g完全是N2O4,则N2O4的物质的量为46g÷92 gmol-1=0.5mol,一个分子中含有6个原子,所以46g的N2O4含有原子的物质的量是3mol,其数目为3NA,因此,无论是46g的NO2,还是46g的N2O4,还是46g的NO2和N2O4混合气体中含有原子总数均为3NA,故C项错误;D项,标准状况下,氨水不是气体,无法用气体摩尔体积计算,故D错误。综上,选A。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:____________,某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是____________。
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+____________,BF3____________。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应方程式____________、_________。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为____________;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解无关的是
A. 粗盐在空气中易潮解 B. NH4Cl用于金属焊接中除锈
C. 用热纯碱溶液去油污 D. 蒸干并灼烧FeCl3溶液得到Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用。其流程图如下。已知FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。

金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出率可以采用的方法是(写出其中一点即可)______________。
(2)滤液I中有少量的AsO33-,若不除去,则AsO33-与Cd反应会产生一种有毒氢化物气体,该气体的分子式为_________。向滤液I中逐滴滴人酸性KmnO4溶液可与AsO33-发生反应生成FeAsO4,完成该反应的离子方程式:_________
___Fe2++___AsO33-+___MnO4-+ □= Mn2++ FeAsO4↓+ □,判断该滴定终点的现象是_______。
(3)流程中②调节pH时可以选用的试剂为________,滤渣Ⅱ的主要成份为________。
(4)常温下Zn(OH)2的溶度积Ksp=_____________________。
(5)制得的ZnSO4 7H2O需洗涤,洗涤晶体时应选用试剂为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl![]() NaCl+NH4NO2
NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2仅是氧化剂
②NH4NO2仅是还原剂
③NH4NO2发生了分解反应
④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A.①③ B.①④
C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热NaHCO3的饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)写出NaHCO3水解的离子方程式__________,甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强。
(2)乙同学认为溶液的pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_______NaHCO3(选填“>”、“<”或“=”)
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_______(选填“甲”或“乙”)判断正确。试剂X是_________。
A. Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
②将加热后的溶液冷却到10℃,若溶液的pH____8.3(选填“>”、“<”或“=”),则__________(选填“甲”或“乙”)判断正确。
③查阅资料,发现NaHCO3的分解温度为150℃,丙断言_____(选填“甲”或“乙”)的判断是错误的,理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
B. 邻二甲苯的一氯取代物有2种
C. 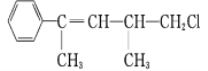 在加热和催化剂作用下,最多能与4 mol H2反应
在加热和催化剂作用下,最多能与4 mol H2反应
D. 由乙烯推测丙烯的结构,丙烯分子中所有原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)阅读、分析下列两个材料:
材料一
物质 | 熔点/℃ | 沸点/℃ | 密度/g/cm3 | 溶解性 |
乙二醇 | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
材料二

回答下列问题(填序号):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好用 ;
②将乙二醇和丙三醇相互分离的最佳方法是___________。
(2)阅读材料三
在溶解性方面,Br2(溴)与I2很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
回答下列问题:
①常用的提取方法是____________,化学试剂是 ,最主要的仪器是 。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中当总质量一定时,不论按何种比例混合,充分混合,充分燃烧后,生成的水的质量为一常量,且生成CO2质量也为一定值的是
A. 乙醇、乙二醇 B. 苯、苯酚 C. 甲烷、乙烯 D. 乙酸、甘油醛(![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com