


分析 E为黑色粉末,在图示转化中均作催化剂,应是利用氯酸钾、过氧化氢在二氧化锰作催化剂条件下制备氧气,可推知固体A为KClO3、B为H2O2,E为MnO2,D为O2,由淡黄色固体C能与水反应可知C为Na2O2,
(1)②反应放出大量的热,温度升高,氢氧化钙的溶解度降低;过氧化钠与水反应生成氧气,该反应为放热反应;
③过氧化钠与水反应生成氢氧化钠和氧气;
(2)F为氢氧化钠,足量氢氧化钠与1molHCl反应生成1mol水,据此写出反应的热化学方程式;
(3)在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X,则无氧酸为HCl、X为Cl2,据此进行解答.
①实验室中用浓盐酸与二氧化锰反应制备氯气;
②加入装置Ⅲ中的氯气应干燥;
③氯气氧化亚铁离子生成铁离子;滴加试剂,观察到溶液呈血红色,应滴加KSCN,反应生成Fe(SCN)3.
解答 解:E为黑色粉末,在图示转化中均作催化剂,应是利用氯酸钾、过氧化氢在二氧化锰作催化剂条件下制备氧气,可推知固体A为KClO3、B为H2O2,E为MnO2,D为O2,由淡黄色固体C能与水反应可知C为Na2O2,
(1)②反应放出大量的热,饱和氢氧化钙溶液的温度升高,氢氧化钙的溶解度降低,会出现浑浊;根据①的检验可知反应生成氧气,根据②可知该反应为放热反应,
故答案为:出现浑浊(或“产生白色沉淀”);反应放热;有氧气生成;
③过氧化钠与氧气反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)过氧化钠与水反应生成氢氧化钠和氧气,则F为NaOH,在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀盐酸完全反应时放出a kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-a kJ/mol(或H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol),
故答案为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-a kJ/mol(或H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol);
(3)在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X,则无氧酸为HCl、X为Cl2,
①实验室中制取氯气的离子方程式为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②加入装置Ⅲ中的氯气应干燥,应在在装置II、Ⅲ之间加入一个盛有浓硫酸的洗气瓶,
故答案为:在装置II、Ⅲ之间加入一个盛有浓硫酸的洗气瓶;
③氯气氧化亚铁离子生成铁离子,装置Ⅳ中可观察到溶液由浅绿色变为黄色;滴加试剂,观察到溶液呈血红色,应滴加KSCN,反应生成Fe(SCN)3,反应有关离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3,
故答案为:溶液由浅绿色变为黄色;KSCN.
点评 本题考查无机推断、性质方案的设计,题目难度中等,根据题干信息正确推断物质名称为解答关键,注意掌握常见元素及其化合物性质,试题有利于提高学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①Ⅰ | B. | ②Ⅱ | C. | ③Ⅲ | D. | ④Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 最合理的方案.
最合理的方案.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
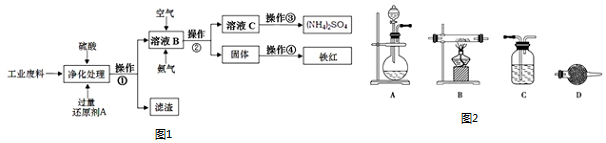
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
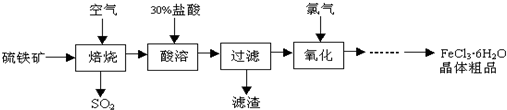
 +6SO2,则
+6SO2,则 中的化学式为Fe3O4,反应中化合价升高的元素有铁、硫.
中的化学式为Fe3O4,反应中化合价升高的元素有铁、硫.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com