

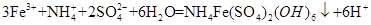 (3分)
(3分)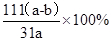 (3分)
(3分)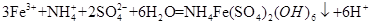 ;
; 2CuO+CO2↑+H2O↑,由差量法可得
2CuO+CO2↑+H2O↑,由差量法可得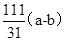 g,此样品中碱式碳酸铜的质量分数是
g,此样品中碱式碳酸铜的质量分数是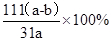 。
。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源:不详 题型:单选题
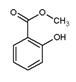 )具有冬青味,故又名冬青油,主要用于制造杀虫剂、杀菌剂、香料、涂料等。用水杨酸(
)具有冬青味,故又名冬青油,主要用于制造杀虫剂、杀菌剂、香料、涂料等。用水杨酸( )与甲醇酯化而得的冬青油中往往会混有未反应完全的水杨酸,若要进行提纯,适宜的洗涤剂为( )
)与甲醇酯化而得的冬青油中往往会混有未反应完全的水杨酸,若要进行提纯,适宜的洗涤剂为( )| A.NaHCO3溶液 | B.NaOH溶液 | C.Na2CO3溶液 | D.NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:将菠菜研磨后,浸泡、过滤得到澄清待测溶液。 | |
| 步骤2:调节溶液至弱碱性,滴加足量CaCl2溶液。 | 出现白色沉淀,说明菠菜中可能含有草酸盐和碳酸盐。 |
| 步骤3:取步骤2的沉淀于试管中, | |
| 步骤4: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| | 密度 (g·mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 |
| 苯甲酸 | 1.2659 | 122.13℃ | 249℃ | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 °C | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂 |
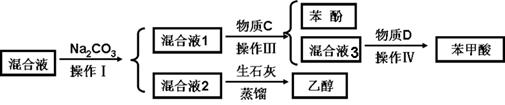
| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加________________________, 振荡,静置 | |
| ②取少量步骤①上层清夜于试管,滴加__________________ ____________________________________________________ | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加___________________,振荡 | _________________________, 说明混合液1不含有酚羟基 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
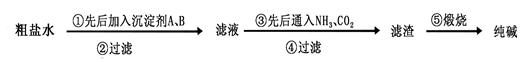
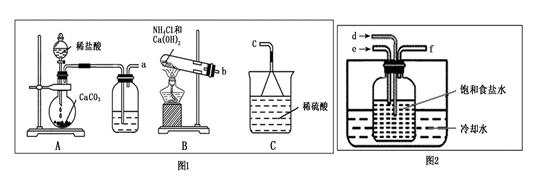
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| B.取少量X溶液,加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含SO42- |
| D.某无色溶液用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液含有Na+无K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl3溶液 | B.稀硫酸 |
| C.酸性高锰酸钾溶液 | D.NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该晶体中一定含有SCN- | B.Fe3+的氧化性比氯气的氧化性强 |
| C.Fe2+被Cl2氧化为Fe3+ | D.Fe3+与SCN-能形成红色的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com