
����Ŀ��NaCN����ĵ�Ʒ�ˮ��������������������
��.NaCN��NaClO��Ӧ������NaOCN��NaCl
��.NaOCN��NaClO��Ӧ������Na2CO3��CO2��NaCl��N2
��֪HCN��Ki=6.3��10��10���о綾��HCN��HOCN��NԪ�صĻ��ϼ���ͬ��
���������գ�
��1����һ������ʱ����Һ��pHӦ����Ϊ��ѡ����ԡ��������ԡ������ԡ�����ԭ���� ��
��2��д���ڶ�������ʱ������Ӧ�����ӷ���ʽ��
��3������100m3��NaCN10.3mg/L�ķ�ˮ��ʵ��������NaClOg��ʵ������ӦΪ����ֵ��4����������ʹNaCN��������0.5mg/L���ﵽ�ŷű���
��4����CN��2��Cl2�Ļ�ѧ�������ƣ���CN��2��NaOH��Һ��Ӧ��������H2O��
��5��������Ӧ�漰����Ԫ���У���ԭ�Ӻ������������ߵĵ����Dz�����H��C��N��O��Na��ԭ�Ӱ뾶��С�����˳��Ϊ ��
��6��HCN��ֱ���ͷ��ӣ�HCN�����ӣ�ѡ����ԡ��Ǽ��ԡ�����HClO�ĵ���ʽΪ ��
���𰸡�
��1�����ԣ���ֹ����HCN�������Ա�ж�����Ⱦ����
��2��2OCN��+3ClO��=CO32��+CO2��+3Cl��+N2��
��3��14900
��4��NaOCN��NaCN
��5��3p��H��O��N��C��Na
��6�����ԣ�![]()
����������1��NaCN�����ᷴӦ����HCN��Ϊ��ֹ����HCN�������Ա�ж�����Ⱦ��������˵�һ������ʱ����Һ��pHӦ����Ϊ���ԣ�
���Դ��ǣ����ԣ���ֹ����HCN�������Ա�ж�����Ⱦ������
��2����Ӧ����Ԫ�صĻ��ϼ۴�+1�۽��͵���1�ۣ��õ�2�����ӣ�NԪ�ػ��ϼ۴ө�3�����ߵ�0�ۣ�ʧȥ3�����ӣ�����ݵ��ӵ�ʧ�غ��֪��ԭ���������������ʵ���֮����2��3����ȷ����Ӧ�����ӷ���ʽ�����Դ��ǣ�2OCN��+3ClO��=CO32��+CO2��+3Cl��+N2����
��3���μӷ�Ӧ��NaCN�ǣ� ![]() =20mol����Ӧ��C��+2�����ߵ�+4�ۣ�NԪ�ػ��ϼ۴ө�3�����ߵ�0�ۣ���1molNaCNʧȥ5mol���ӣ�1mol�������Ƶõ�2mol���ӣ����Դ���100 m3��NaCN 10.3 mg/L�ķ�ˮ��ʵ��������NaClO������Ϊ��
=20mol����Ӧ��C��+2�����ߵ�+4�ۣ�NԪ�ػ��ϼ۴ө�3�����ߵ�0�ۣ���1molNaCNʧȥ5mol���ӣ�1mol�������Ƶõ�2mol���ӣ����Դ���100 m3��NaCN 10.3 mg/L�ķ�ˮ��ʵ��������NaClO������Ϊ�� ![]() ��74.5g/mol��4=14900g�����Դ��ǣ�14900��
��74.5g/mol��4=14900g�����Դ��ǣ�14900��
��4����CN��2��Cl2�Ļ�ѧ�������ƣ���������������������Һ��Ӧ��ԭ����֪����CN��2��NaOH��Һ��Ӧ����NaOCN��NaCN����H2O��
���Դ��ǣ�NaOCN��NaCN��
��5����ԭ�ӵĺ��ҵ����Ų�ʽΪ��1s22s22p63s23p5 �� ������ԭ�Ӻ��������������ߵĵ����Dz�Ϊ3p��ԭ�ӵĵ��Ӳ�Խ�࣬ԭ�Ӱ뾶Խ���Ӳ���ͬʱ��ԭ�ӵĺ˵����Խ��ԭ�Ӱ뾶ԽС�����Դ��ǣ�3p��H��O��N��C��Na��
��6��HCN��ֱ���ͷ��ӣ�����������ɵ����IJ��غϣ���HCNΪ���Է��ӣ�HClOΪ���ۻ���������к���1��O��Cl����H��O���������ʽΪ ![]() �����Դ��ǣ����ԣ�
�����Դ��ǣ����ԣ� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��R��ZΪ���ֶ�����Ԫ�أ���Ԫ�����ڱ��е�λ����ͼ��ʾ����֪RԪ�ص���������������������������˵����ȷ����( )
X | Y | |||
R | Z |
A.����Ԫ�ص�ԭ���У�Yԭ�ӵİ뾶���
B.Y��X��ɵĻ���������ˮ������
C.���R��Z��ɵĻ������Ʊ�R����
D.Һ̬Z���ʿ��Ա����ڸ�ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ˮ��Һ�п��ܺ������������е������֣�Na+��Al3+��Fe3+��Mg2+��Ba2+��NH ![]() ��Cl����SO
��Cl����SO ![]() ���ֱַ�ȡ100mL��������Һ��������ʵ�飮 �ٵ�һ�ݼӹ���NaOH��Һ����ȣ��ռ���0.03mol���壬�������ɣ�ͬʱ�õ���Һ�ף�
���ֱַ�ȡ100mL��������Һ��������ʵ�飮 �ٵ�һ�ݼӹ���NaOH��Һ����ȣ��ռ���0.03mol���壬�������ɣ�ͬʱ�õ���Һ�ף�
�������Һ��ͨ�����CO2 �� ���ɰ�ɫ���������������ˡ�ϴ�ӡ����պõ�1.02g���壮
�۵ڶ��ݼ�����BaCl2��Һ�����ɰ�ɫ���������˺�ij�������������ϴ�ӡ�����õ�23.3g���壬����Һ�м���AgNO3��Һ���а�ɫ���������������й�������ȷ���ǣ� ��
A.�ɢٿ�֪ԭ��Һ��������ΪNH4+ �� ��Ũ��Ϊ0.03mol/L
B.ԭ��Һ�϶�û��Fe3+��Mg2+ �� һ������Na+
C.n��NH ![]() ����n��Al3+����n��SO
����n��Al3+����n��SO ![]() ��=3��1��10
��=3��1��10
D.ԭ��Һһ������Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ���ش��������⣮
��1��SiO2�Dz�������Ҫ�ɷ�֮һ��SiO2������������Һ��Ӧ�Ļ�ѧ����ʽΪ �� ����ʦ���������������ƣ�����̲�����
��2��������ͭ��Һ����μ���KI��Һ��ǡ�÷�Ӧ��ȫ���۲쵽������ɫ����CuI����ɫ��Һ��Ϊ��ɫ���÷�Ӧ�����ӷ���ʽΪ��ȡһ����������Ӧ����ϲ���ɫ��Һ��һ֧�Թ��У�����һ�����ı�������ʱ�۲쵽�������� ��
��3�����ӹ�ҵ����FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ������ӡˢ��·�壬����ʦ��������ӡˢ��·��Ĺ�ҵ��ˮ�л���ͭ�������FeCl3��Һ��������·�����
�������ijɷ�Ϊ �� ���ѧʽ��
�ڼӹ���B������Ӧ�����ӷ���ʽΪ ��
��ͨ��C������Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ֧50mL��ʽ�ζ�����ʢ���ᣬҺ��ǡ����amL�̶ȴ����ѹ���Һ��ȫ���ų���ʢ����Ͳ�ڣ�����Һ�����һ���ǣ� ��
A. a mLB. ��50�Da��mLC. ���ڣ�50�Da��mLD. ����amL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʱȽϲ���ȷ���ǣ� ��
A.�����۵�ĸߵͣ� 
B.Ӳ���ɴ�С�����ʯ��̼���裾�����
C.�۵��ɸߵ��ͣ�Na��Mg��Al
D.�������ɴ�С��NaF��NaCl��NaBr��NaI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������İ��ˡ��Ƽ����ˡ���ɫ���ˡ���2008�걱�����˻����Ҫ���������н�ֹ�˶�Աʹ���˷ܼ�����Ҫ�ٴ�֮һ����ͼ�����˷ܼ��Ľṹ�ֱ�Ϊ����������ǵ�˵������ȷ���ǣ� �� 
A.���������������������ֺ��������ţ��ں˴Ź��������Ϲ����߸���
B.1 mol�˷ܼ�X������Ũ��ˮ��Ӧ���������4 mol Br2
C.�����˷ܼ����ܺͺ�3molNaOH����Һ��Ӧ
D.���ַ����е�����̼ԭ�Ӿ������ܹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڷ�Ӧ3H2+N22NH3�У���һ��ʱ�����Ũ��������0.6mol/L���ڴ�ʱ������H2��ʾ��ƽ����Ӧ����Ϊ0.45mol/��Ls������Ӧ��������ʱ��Ϊ�� ��
A.0.44 s
B.2 s
C.0.33 s
D.1 s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش���������
��1���������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ�ϡ���������Ӧ�õ��������߿Ƽ�����λ������A��B����ȼ��ʱ���ų������ȣ�������ȼ�ϣ���֪A��BΪ������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
�����ܣ�kJ/mol�� | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
��ijͬѧ����������Ϣ���ƶ�B�ĺ�������Ų���ͼ1��ʾ����ͬѧ�����ĵ����Ų�ͼΥ�� �� BԪ��λ�����ڱ���������е���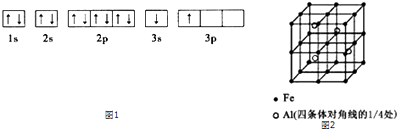
��ACl2������A���ӻ�����Ϊ �� ACl2�Ŀռ乹��Ϊ ��
��2��Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ�����
�������������ѻ��γɵĽ������У���ԭ�ӵ���λ��Ϊ ��
��д��һ����CN����Ϊ�ȵ�����ĵ��ʵĵ���ʽ ��
���������������[Fe��CN��6]4������� ��
A�����ۼ� B���Ǽ��Լ� C����λ�� D���Ҽ� E���м�
��3��һ��Al��Fe�Ͻ�����徧����ͼ2��ʾ����ݴ˻ش��������⣺
��ȷ���úϽ�Ļ�ѧʽ ��
����������ܶ�=�� g/cm3 �� ��˺Ͻ������������Feԭ��֮��ľ��루�ú��ѵĴ���ʽ��ʾ�����ػ���Ϊcm��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com