
【题目】某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取漂白粉,据此回答下列问题:

(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应的化学方程式 。
(2)漂白粉将在U形管中产生,其化学方程式是
(3)C装置的作用是 。
(4)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是( )
A.食盐 B.纯碱 C.烧碱 D.食醋
【答案】(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)吸收多余的CI2,防止污染空气;(4)D。
【解析】
试题分析:(1)装置A是制取氯气,因此反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;(2)装置B制取漂白粉,漂白粉的成分是Ca(ClO2)和CaCl2,因此反应方程式为:2Cl2 +2Ca(OH)2 =CaCl2 +Ca(ClO)2 +2H2O;(3)氯气有毒,对环境有危害,因此装置C的作用是吸收多余的氯气,防止污染空气,发生Cl2+2NaOH=NaCl+NaClO+H2O;(4)漂白粉的有效成分是Ca(ClO)2,增强漂白性,就是增强HClO的浓度,利用酸性强的制取酸性弱的,醋酸的酸性强于次氯酸,因此选用醋酸,故选项D正确。
MnCl2+Cl2↑+2H2O;(2)装置B制取漂白粉,漂白粉的成分是Ca(ClO2)和CaCl2,因此反应方程式为:2Cl2 +2Ca(OH)2 =CaCl2 +Ca(ClO)2 +2H2O;(3)氯气有毒,对环境有危害,因此装置C的作用是吸收多余的氯气,防止污染空气,发生Cl2+2NaOH=NaCl+NaClO+H2O;(4)漂白粉的有效成分是Ca(ClO)2,增强漂白性,就是增强HClO的浓度,利用酸性强的制取酸性弱的,醋酸的酸性强于次氯酸,因此选用醋酸,故选项D正确。


科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
![]()
(1)判断BaCl2已过量的方法是 。
(2)第④步中,相关的化学方程式是 。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解( ) |
B.天平的砝码已锈蚀( ) |
C.定容摇匀时,液面下降又加水( ) |
D.定容时俯视刻度线( ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向AgCl饱和溶液中加水,下列叙述正确的是( )
A. 结晶过程停止,溶解过程加快 B. 溶解度、Ksp均变大
C. 溶解度、Ksp均不变 D. 结晶过程将小于溶解过程,直至再达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s)+1/2(g)=CO(g) △H=-110.5kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是
A. 172.5kJ B. 1149kJ C. 283kJ D. 517.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确是
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确是
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol·L-1 | 0.010 | 0.020 | 0.020 |
c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.020[ |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g液态甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为: 。
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。写出1mol N2和O2完全反应的热化学方程式为: 。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。请回答下列问题。
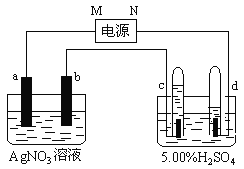
(1)直流电源中,N为 极。
(2)AgNO3溶液的浓度___________(填增大、减小或不变。下同),H2SO4溶液的pH ,若要硫酸恢复成原溶液需加入
(3)Pt电极上生成的物质是 ,其质量为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com