
(12分)CoCl2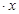 H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2
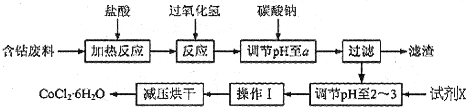
H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2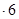 H2O的一种新工艺流程如下图:
H2O的一种新工艺流程如下图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2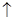
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
|
|
|
|
开始沉淀 |
2.3 |
7.6 |
3.4 |
|
完全沉淀 |
4.1 |
9.2 |
5.2 |
请回答下列问题:
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:__________
(2)加入碳酸钠调节pH至a,a的范围是__________;
(3)最合适的试剂X是__________
(4)操作I包含3个基本实验操作,它们是__________、__________和减压过滤。
(5)制得的CoCl2·6H2O需减压烘干的原因是__________。
(1)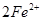
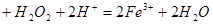 (2)5.2~7.6
(2)5.2~7.6
(3)盐酸 (4)蒸发浓缩、冷却结晶 (5)降低烘干温度,防止产品分解
【解析】(1)要制取制取CoCl2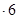 H2O,就必须除去溶液中的杂质离子,因此双氧水的作用是将亚铁离子氧化生成铁离子,易于以氢氧化铁的形式沉淀而除去,方程式为2Fe2+H2O2+2H+=2Fe3+2H2O。
H2O,就必须除去溶液中的杂质离子,因此双氧水的作用是将亚铁离子氧化生成铁离子,易于以氢氧化铁的形式沉淀而除去,方程式为2Fe2+H2O2+2H+=2Fe3+2H2O。
(2)根据表中数据可知,当pH大于7.6是开始析出氢氧化钴沉淀,所以pH不能大于7.6。而氢氧化铝的沉淀分为是3.4~5.2,所以a的分为是5.2~7.6。
(3)因为不能引入新的杂质,所以应该用盐酸酸化,即X是盐酸。
(4)要得到晶体,需要蒸发浓缩、冷却结晶,最后过滤即可。
(5)因为氯化钴晶体受热以分解,所以需要降低烘干温度,防止产品分解。


科目:高中化学 来源: 题型:






| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省绍兴市鲁迅中学高二下学期期末考试化学试卷(带解析) 题型:实验题
(12分)CoCl2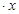 H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2
H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2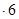 H2O的一种新工艺流程如下图:
H2O的一种新工艺流程如下图: 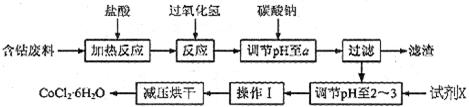
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2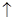
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | 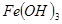 | 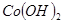 | 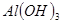 |
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
CoCl2![]() H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2
H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2![]() H2O的一种新工艺流程如下图:
H2O的一种新工艺流程如下图:
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2![]()
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
|
|
|
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
请回答下列问题:
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:__________
(2)加入碳酸钠调节pH至a,a的范围是__________;
(3)最合适的试剂X是__________
(4)操作I包含3个基本实验操作,它们是__________、__________和减压过滤。
(5)制得的CoCl2·6H2O需减压烘干的原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com