合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N
2(g)+3H
2(g)?2NH
3(g)△H=-92.2kJ?mol
-1.合成氨工业中原料气N
2可从空气中分离得到,H
2可用甲烷或焦炭与水蒸气反应制得.
(1)在一容积固定的密闭容器中注入N
2和H
2两种气体,发生上述反应.在某温度下达到平衡时,各物质的浓度分别是:c(H
2)=9.00mol?L
-1,c(N
2)=3.00mol?L
-1,c(NH
3)=4.00mol?L
-1,此温度下该反应的平衡常数K=
7.32×10-3
7.32×10-3
.
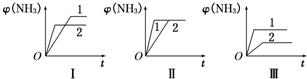
(2)在三个相同容器中各充入1mol N
2和3mol H
2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示.下列说法中正确的是
D
D
(填字母,下同).
A.图Ⅰ可能是不同压强对反应的影响,且p
2>p
1B.图Ⅱ可能是不同压强对反应的影响,且p
1>p
2C.图Ⅲ可能是不同温度对反应的影响,且T
1>T
2D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,通过乙醇制取氢气
具有良好的应用前景.已知通过乙醇制取氢气有如下两条路线:
a、CH
3CH
2OH(g)+H
2O(g)?4H
2(g)+2CO(g)△H=+255.58kJ/mol
b、CH
3CH
2OH(g)+1/2O
2(g)?3H
2(g)+2CO(g)△H=+13.76kJ/mol
下列说法错误的是:
D
D
A.从原料消耗的角度来看,a路线制氢更有价值
B.从能量消耗的角度来看,b路线制氢更加有利
C.a路线制氢由于要消耗很多能量,所以在实际生产中意义不大
D.降低温度,可提高b路线中乙醇的转化率.

