
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 1 mol Cl2与足量Fe反应,转移的电子数为3NA
B. 1 mol Cl2参加反应转移的电子数一定为2NA
C. 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA
D. 在反应KIO3+6HI![]() 3I2+KI+3H2O中,每生成3 mol I2转移的电子数为5NA
3I2+KI+3H2O中,每生成3 mol I2转移的电子数为5NA
【答案】D
【解析】
A项,1molCl2与足量的铁反应生成FeCl3,1molCl2全部反应,转移电子数为2NA,故A错误;B项,1 mol Cl2参加反应,可能被氧化、也可能被还原、还可能自身氧化还原,所以转移的电子数不一定为2NA,故B错误;C项,向FeI2溶液中通入Cl2,首先反应的是I-:FeI2+Cl2=FeCl2+I2,I-全部转化为I2后,Cl2再和Fe2+反应,当有1molFe2+被氧化时反应为:2FeI2+3Cl2=2FeCl3+2I2,则参加反应的Cl2的物质的量为1.5mol,即有1.5mol Cl2被还原,所以电子转移数目为3NA,故C错误;D项,KIO3中的I元素化合价从+5价到I2中的0价,得电子数为5,HI中的I元素化合价从-1价到I2中的0价,失电子数为1,根据电子得失守恒,反应6molHI中只有5molHI被氧化,所以每生成3 mol I2转移的电子数为5NA,故D正确。综上所述,符合题意的选项为D。


科目:高中化学 来源: 题型:
【题目】欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
方法二:
方法三:
方法四:运用化学原理,但不使用其他化学试剂,仅使用实验室常用仪器达到实验目的。
按要求回答下列问题:
(1)方法一:加入足量的试剂A ______________ (填写A的化学式)可将HCO3―离子转化为沉定并称重,反应的离子方程式为 ______________。操作1、2、3、4的名称依次是溶解、______________ 、洗涤和干燥(烘干)。
(2)方法二:在操作1中配制100 mL待测液所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要用到的是 ______________,操作2中选择甲基橙作指示剂,计算该样品中NaHCO3的质量分数为 ______________ [用流程图中的数据m、V(HCl),填写有关的表达式]。
(3)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是______________。
(4)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是______________,偏低的原因可能是______________ (均用文字简述)。
(5)方法四的实验原理是:______________ (用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的表述正确的( )
A. 醋酸的电离方程式:CH3COOH= CH3COO-+H+
B. H216O、H218O互为同位素
C. 质子数为53,中子数为78的碘原子:13153I
D. 氯离子的结构示意图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液分别滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
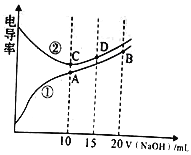
A. 曲线①代表滴定HCl溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)+c(H+)=0.1mol/L
C. 在相同温度下,A、B、C三点溶液中水的电离程度: C<B<A
D. D点溶液中:2c(Na+)=3c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴室温时,在下列物质中:①Na ②Cl2 ③Na2O ④FeCl2溶液 ⑤NaHCO3 ⑥蔗糖 ⑦NH3⑧NaCl晶体 ⑨HClO ⑩ Fe(OH)2
属于碱性氧化物的是(用序号填写,下同) __________,属于酸的是________,属于强电解质的是____________,属于非电解质的是____________,能导电的是___________。
⑵下列各组化学用语中:①3He、4He ② 2H2 O、1H2O ③ 1H、3H ④14N和13C质子数相同的有_________,中子数相同的有________,互为同位素的有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为:2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡继续通入Cl2,逆反应速率____(填增大、减少、不变)。
(2)已知几种化学键的键能数据如下表(NO的结构为:N≡O;亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能(kJ/mol) | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol则a=______。
2ClNO(g) △H=-111kJ/mol则a=______。
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
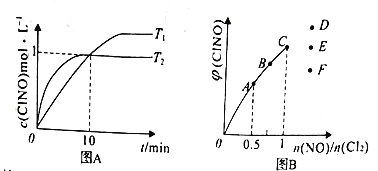
①该反应的T1______T2(填“>”<”或“=”)。
②反应开始到10min时NO的平均反应速率v(NO)=_______mol/(L.min)。
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是_____点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)在元素周期表中M位于_____区,基态M原子的价层电子排布图为_____,第四能层s轨道上电了数目和M元素相同的元素还有_____(填元素符号)。
(2)元素Y基态原子的核外电子排布式为_______,其同周期元素中,第一电离能最大的是____(写元素符号)。元素Y的含氧酸中,酸性最强的是_____(写化学式),该酸根离子的立体构型为_______。
(3)Z与元素Y同主族,在该族中原子序数最小,Z的气态氢化物的稳定性大于Y的气态氢化物的稳定性,原因是__________,Z的气态氢化物的沸点大于Y的气态氢化物的沸点,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的NaCl、MgCl2、AlCl3三种溶液分别与等体积等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液的物质的量浓度之比是
A. 1:1:1 B. 1:2:3 C. 3:2:1 D. 6:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com