
【题目】⑴室温时,在下列物质中:①Na ②Cl2 ③Na2O ④FeCl2溶液 ⑤NaHCO3 ⑥蔗糖 ⑦NH3⑧NaCl晶体 ⑨HClO ⑩ Fe(OH)2
属于碱性氧化物的是(用序号填写,下同) __________,属于酸的是________,属于强电解质的是____________,属于非电解质的是____________,能导电的是___________。
⑵下列各组化学用语中:①3He、4He ② 2H2 O、1H2O ③ 1H、3H ④14N和13C质子数相同的有_________,中子数相同的有________,互为同位素的有________。
【答案】③ ⑨ ③⑤⑧ ⑥⑦ ①④ ①②③ ④ ①③
【解析】
本题主要考查酸、碱、盐、氧化物的概念及其相互联系,电解质与非电解质的概念以及相关化学用语;
(1)碱性氧化物:能与酸反应只生成一种盐和水,主要包括绝大多数金属氧化物;酸:电离时产生的阳离子全部都是氢离子的化合物;强电解质:在水溶液中或熔融状态下能发生完全电离的化合物;非电解质:在水溶液中或熔融状态下不发生电离的化合物;能导电的物质有大多数金属单质或存在有自由移动电荷的物质;根据物质特点结合定义解答;
(2)对于原子![]() 而言:Z为质子数,同一元素的质子数不变,X-Z为原子的中子数,质子数相同而中子数不同的原子互为同位素,根据定义进行解答即可。
而言:Z为质子数,同一元素的质子数不变,X-Z为原子的中子数,质子数相同而中子数不同的原子互为同位素,根据定义进行解答即可。
(1)属于碱性氧化物的是Na2O;属于酸的是HClO; 属于强电解质的是Na2O、NaHCO3、NaCl晶体,属于非电解质的是蔗糖、NH3,能导电的是Na、FeCl2溶液;故属于碱性氧化物的是③;属于酸的是⑨;属于强电解质的是③⑤⑧;属于非电解质的是⑥⑦;能导电的是①④;
(2)由上述分析可知,①3He、4He的质子数均为2,中子数分别为1、2;②2H2O、1H2O 的质子总数均为10,中子总数分别为10、8;③1H、3H的质子数均为1,中子数分别为0、2;④14N和13C的质子数分别为7、6,中子数均为7;由此可知质子数相同的是①②③;中子数相同的是④;互为同位素的是①③。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】燃煤产生的SO2会污染空气。某实验小组用下图装置(夹持仪器略、气密性好)探究SO2的性质,并研究治理措施。

(1)装置①中反应的化学方程式是_______________。
(2)从物质类别的角度分析,SO2和CO2具有相似的化学性质,欲验证该性质,②中可选用的试剂及预期的实验现象是_________________。
(3)当②中为氢硫酸(溶质为H2S)时,观察到②中出现黄色沉淀,说明SO2具有的化学性质是_______________。
(4)当②中为碘水时,观察到②中溶液由黄色变为无色,由此推测所得无色溶液中的离子主要是H+、I-和_________;通过进一步实验证实了该过程中SO2已被氧化,实验操作及现象是______________。
(5)结合SO2的性质,请你针对煤的使用及其产生的环境污染提出一条解决或缓解的建议:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备,正丁烷(C4H10)催化脱氢制1-丁烯(C4H8) 的化学方程式如下:C4H10(g)=C4H8(g)+H2(g)△H,如图是该反应平衡转化率与反应温度及压强的关系图,下列说法正确的是
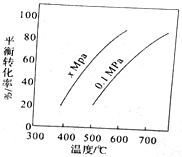
A. x>0.1
B. △H>O
C. 500C时,压强xMPa比0.1MPa条件下的平衡常数大
D. 一定温度下,在一恒容密闭容器中发生该反应,C4H10的浓度越高,平衡转化率越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 1 mol Cl2与足量Fe反应,转移的电子数为3NA
B. 1 mol Cl2参加反应转移的电子数一定为2NA
C. 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA
D. 在反应KIO3+6HI![]() 3I2+KI+3H2O中,每生成3 mol I2转移的电子数为5NA
3I2+KI+3H2O中,每生成3 mol I2转移的电子数为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,其原子序数依次增大。其中A元素原子核内只有一个质子;A与C、B与D分别同主族;B、D两元素原子序数之和是A、C两元素原子序数之和的2倍。
请回答下列问题:
(1)由上述元素组成的下列物质中属于非电解质的是____(填字母)。
A.A2B B.DB2 C.E2 D.C2DB3
(2)D元素在元素周期表中的位置为____;化合物C2B中两种离子的半径大小关系为(填离子符号,下同)_________>____。
(3)实验室中欲选用如图所示装置制取并收集纯净干燥的E2气体。
①实验中应选用的装置为_______(按由左到右的连接顺序填写)。
②装置A中发生反应的离子方程式为______。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是__________________________________________________。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)______________________________。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2 mol·L-1, c(Fe3+)=1.0×10-3 mol·L-1,c(Cl-)=5.3×10-2 mol·L-1,则该溶液的pH约为________。
②完成NaClO3氧化FeCl2的离子方程式:
![]() ClO3-+
ClO3-+![]() Fe2++________===
Fe2++________===![]() Cl-+
Cl-+![]() Fe3++
Fe3++![]() ________,______________
________,______________
(3)FeCl3在溶液中分三步水解:
Fe3++H2O ![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是________________。
通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2O![]() Fex(OH)
Fex(OH)![]() +yH+,欲使平衡正向移动可采用的方法是(填序号)________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)________。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
(4)天津某污水处理厂用聚合氯化铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为________mg·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从氧化还原角度分析,下列反应中水的作用相同的是
① 铁和水蒸气反应 ② 过氧化钠和水反应
③氯气和水反应 ④ 二氧化氮和水反应3NO2+H2O=2HNO3+NO
A.①②③B.①②④C.②③④D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com