
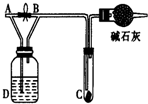
 如图所示,A处通入氯气,关闭旋塞B时,C处红色布条无明显的变化,打开旋塞B时,C处红色布条逐渐褪色.由此作出的判断正确的是( )
如图所示,A处通入氯气,关闭旋塞B时,C处红色布条无明显的变化,打开旋塞B时,C处红色布条逐渐褪色.由此作出的判断正确的是( )| A、D中不可能是浓硫酸 | B、D中可以是水 | C、通入的氯气中含有水蒸气 | D、D中可以是饱和食盐水 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. |
 |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a. a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3: 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 |
b. 若溶液变浑浊,证明固体中含有NaCl 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
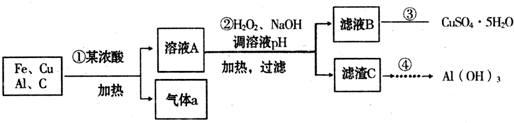
(10分)黄铁矿(主要成分为FeS2)曾是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O22Fe2O3+8SO2
II.反应结束后,将乙瓶中的溶液进行如下图所示处理。
[实验二]测定铁元素的含量。
III.测定铁元素的含量的实验步骤如下图所示。
问题讨论:
(1)上述装置中,甲瓶内所盛试剂是 溶液。
(2)向乙瓶溶液中滴加H2O2溶液时,发生氧化还原反应的离子方程式为 。
II中除了可以用H2O2溶液作为氧化剂,还可以加入 (填序号)。
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为 。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由。(如合理,则此空不填) (填“合理“或”不合理“)、 (如合理,则此空不填)。
(5)若要测定铁元素的含量,则步骤III中还需要测定的数据有 。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年江苏省如皋市第一中学高二学业水平测试化学试卷 题型:实验题
(10分)黄铁矿(主要成分为FeS2)曾是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O22Fe2O3+8SO2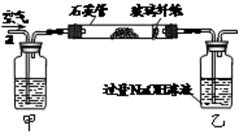
II.反应结束后,将乙瓶中的溶液进行如下图所示处理。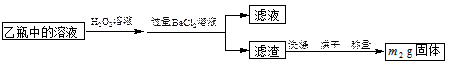
[实验二]测定铁元素的含量。
III.测定铁元素的含量的实验步骤如下图所示。
问题讨论:
(1)上述装置中,甲瓶内所盛试剂是 溶液。
(2)向乙瓶溶液中滴加H2O2溶液时,发生氧化还原反应的离子方程式为 。
II中除了可以用H2O2溶液作为氧化剂,还可以加入 (填序号)。
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为 。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由。(如合理,则此空不填) (填“合理“或”不合理“)、 (如合理,则此空不填)。
(5)若要测定铁元素的含量,则步骤III中还需要测定的数据有 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市六校高三第二次联考理综化学试卷(解析版) 题型:实验题
铁矿石主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。

???????????? A????????????? B???????? C
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;?
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处缓缓通入H2,____________,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为________________________________________________。
(2)③中点燃A处酒精灯前所需操作为 ______________________________ 。
(3)测得反应后装置B增重1.35g,则铁矿石中氧的百分含量为____________。
Ⅱ.铁矿石中含铁量的测定

(1)步骤④中煮沸的作用是__________________________________________。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、____________。
(3)下列有关步骤⑥的操作中说法正确的是__________________。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定颜色变化后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol·L?1KI溶液20.00mL,则铁矿石中铁的百分含量为____________。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为???????????????????????????????? 。
如何检验滤液A中是否含有Fe2+__________(填选项字母)。
A.先加KSCN溶液,再加氯水??? B.加NaOH溶液??? C.加K3[Fe(CN)6]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com