
【题目】硼、砷、锑的化合物用途非常广泛。回答下列问题:
(1)基态砷原子的价电子轨道表达式(电子排布图)为_______________,其未成对电子所在原子的轨道轮廓图形为____________________。
(2)B4C的熔点为2350 ℃、沸点为3500 ℃,说明它属于____________晶体,AsF3的沸点(60.4℃)比SbF3的沸点(376℃)低,其原因是____________________________________。
(3)已知反应:(CH3)3C—F+SbF6→(CH3)3CSbF6,该反应可生成(CH3)3C+,其碳正离子中碳原子杂化方式有____________________________________。
(4)与BF3互为等电子体的分子和离子分别为_______________(各举1例);已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则BF3中的大π键应表示为_________________。
),则BF3中的大π键应表示为_________________。
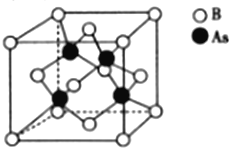
(5)砷化硼的晶胞结构如图所示。与砷原子紧邻的硼原子有_________个,与每个硼原子紧邻的硼原子有_________个,若其晶胞参数为bpm,则其晶体的密度为_________________(列出表达式,设NA为阿伏加德罗常数的数值)g·cm-3。
【答案】 ![]() 哑铃型(纺锤形) 原子 AsF3 与SbF3 是结构相似的分子,AsF3 相对分子质量比SbF3 小 sp2和sp3 SO3 和CO32-(或其他合理答案)
哑铃型(纺锤形) 原子 AsF3 与SbF3 是结构相似的分子,AsF3 相对分子质量比SbF3 小 sp2和sp3 SO3 和CO32-(或其他合理答案) ![]() 4 12 【答题空10】
4 12 【答题空10】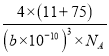
【解析】(1)As为第四周期第ⅤA族元素,所以原子核外价电子排布式为4s24p3,4p轨道中有3个电子,且都是单电子,其价电子轨道排布图为:![]() ;其未成对电子所在原子的轨道为4p轨道,轨道轮廓图形为哑铃型(纺锤形)。
;其未成对电子所在原子的轨道为4p轨道,轨道轮廓图形为哑铃型(纺锤形)。
(2)B4C由两种非金属元素组成,不可能为离子晶体,又因为其熔沸点很高,所以应属于原子晶体;AsF3和SbF3的沸点都比较低,都是由分子构成的,并且结构相似,AsF3相对分子质量比SbF3小,所以AsF3的沸点比SbF3的沸点低。
(3)(CH3)3C+中,甲基上的C原子形成4条单键,属于sp3杂化,中心C原子形成3条单键,价电子层仅有六个电子,无孤对电子,属于sp2杂化。
(4)等电子体是指具有相同价电子数目和原子数目的分子或离子,所以与BF3互为等电子体的分子可以是SO3、BCl3等,与BF3互为等电子体的离子可以是CO32-、NO3-等;因为大π键的符号![]() 中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),又因为BF3中参与形成大π键的原子数为4,形成大π键的电子数为6,所以BF3中的大π键表示为:
),又因为BF3中参与形成大π键的原子数为4,形成大π键的电子数为6,所以BF3中的大π键表示为: ![]() 。
。
(5)根据晶胞结构图可以判断,砷原子(黑球)与周围4个硼原子(白球)形成单键,则与砷原子紧邻的硼原子有4个。根据晶胞结构图,设棱长为b,以立方体上面面心的硼原子(白球)为例分析,该硼原子与除了对面上的5个硼原子之外的其他8个硼原子紧邻,距离都是![]() b;又因为该硼原子属于上下相邻两个晶胞共有(上方的晶胞未画出),同理,该硼原子还与其上方的立方体中除对面外的其他四个面面心上的硼原子紧邻,距离都是
b;又因为该硼原子属于上下相邻两个晶胞共有(上方的晶胞未画出),同理,该硼原子还与其上方的立方体中除对面外的其他四个面面心上的硼原子紧邻,距离都是![]() b,综上分析,与每个硼原子紧邻的硼原子共有12个。由均摊法计算晶胞原子数:4个砷原子(黑球)都在晶胞内部,故砷原子数为4,硼原子有8个在顶点、6个在面心,故硼原子数为8×
b,综上分析,与每个硼原子紧邻的硼原子共有12个。由均摊法计算晶胞原子数:4个砷原子(黑球)都在晶胞内部,故砷原子数为4,硼原子有8个在顶点、6个在面心,故硼原子数为8×![]() +6×
+6×![]() =4个,所以晶胞质量为:
=4个,所以晶胞质量为: ![]() g,因为bpm=b×10-10cm,所以晶胞体积为:(b×10-10)3cm3,根据密度=质量÷体积,所以晶胞密度为:
g,因为bpm=b×10-10cm,所以晶胞体积为:(b×10-10)3cm3,根据密度=质量÷体积,所以晶胞密度为: 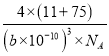 g·cm-3。
g·cm-3。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】催化剂是在化学反应前后质量和化学性质不变的物质,研究表明催化剂有吸附和解吸过程。
(1)铁通过对N2、H2吸附和解吸可作为合成氨的固体催化剂。若用![]() 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:

①吸附后,能量状态最低的是________________(填字母序号)。
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图2。从吸附和解吸过程分析,c0前速率增加的原因可能是____________________;c0后速率降低的原因可能是_______________________________________________。
(2)二氧化锰可以作为过氧化氢分解的催化剂,请写出在酸性条件下二氧化锰参与过氧化氢分解的离子反应方程式____________________、___________________。
(3)将等物质的量的N2、H2放入一密闭容器中发生反应,达到平衡后,N2的体积分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁铝合金样品分成两等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2L。则原合金样品中镁的质量为
A. 4.8 g B. 6 g C. 9.6 g D. 12 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某饱和溶液中含有三种阳离子:Ag+、Ba2+、Al3+,同时测知此溶液中pH=3,则该溶液中所含有的阴离子可以是下列中的()
A.CO32-B.SO42-C.NO3-D.Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,A、B、C三种气态物质的物质的重随时间变化曲线如图所示。请回答以下问题:
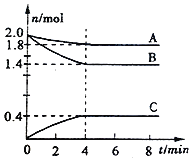
(1)该反应的化学方程式是___________。
(2)反应从开始到平衡时,气体C的平均反应速率是_______ 。
(3)反应达平衡,反应物B的转化率是___;体系的压强是开始时的______倍。
(4)其他条件不变,升高温度,逆反应速率将________(填“加快”、“减慢”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。请回答下列问题:

(1)写出化学式:A__________C__________
(2)写出下列反应的离子方程式:
A→B:________________________________。
B→D:________________________________。
C→E:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了x g,则( )
A. 电解液质量增加x g B. 阴极质量增加x g
C. 阴极质量增加a g,a>x D. 阴极质量增加b g,b<x
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com