
【题目】2016年10月17日我国神舟十一号载人飞船在酒泉卫星发射中心成功发射,为我们更好地掌握空间交会对接技术、开展地球观测活动奠定了基础。我国制造航天飞船的主要材料是铝,因而其也被称为会飞的金属,请根据其性质回答下列问题:
(1)现在工业冶炼铝的化学方程式为 。
(2)铝锂合金是今年来航空金属材料中发展最为迅速的一个领域,主要因为合金的某些性能优于各成分金属,其中包括 、 等方面。同时铝锂形成化合物LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,LiAlH4在化学反应中通常作
(填“氧化”或“还原”)剂。
(3)铝电池性能优越,在现代生产、生活中有广泛的应用。
①Al-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”),
②铝一空气电池以其环保、安全而受到越来越多的关注,其原理如下图所示。

该电池的负极反应方程式为 ;正极反应方程式为 ;
电池中NaCl溶液的作用是 ;以该电池为电源,用惰性电极电解Na2SO4溶液,当Al电极质量减少1.8g时,电解池阴极生成的气体在标准状况下的体积为 L。
【答案】(1)2Al2O3(熔融)![]() 4Al+3O2↑(2分)
4Al+3O2↑(2分)
(2)合金的硬度大于各成分金属(1分)合金的熔点低于各成分金属(1分)还原(1分)
(3)①Al+4OH--3e-![]() AlO2-+2H2O(2分)变大(2分)
AlO2-+2H2O(2分)变大(2分)
②4Al-12e-![]() 4Al3+(2分)3O2+12e-+6H2O=12OH-(2分)
4Al3+(2分)3O2+12e-+6H2O=12OH-(2分)
增强溶液的导电能力(1分)2.24(2分)
【解析】
试题分析:(1)工业电解熔融的氧化铝冶炼铝,反应化学方程式为2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
(2)合金的某些性能优于各成分金属,其中包括合金的硬度大于各成分金属、合金的熔点低于各成分金属等方面。LiAlH4和水反应生成LiAlO2和氢气,反应方程式为:LiAlH4+2H2O=LiAlO2+4H2↑,LiAlH4中氢元素的化合价由-1价变为+1价,在化学反应中通常作还原;
(4)该原电池中,负极上铝失电子发生氧化反应,正极上氧气得电子发生还原反应,铝离子和氢氧根离子反应生成氢氧化铝,所以该电池的负极反应方程式为4Al-12e-![]() 4Al3+;正极反应方程式为3O2+12e-+ 6H2O=12OH-;为了增大溶液的导电性且又不对其电池反应式造成影响而选择氯化钠。
4Al3+;正极反应方程式为3O2+12e-+ 6H2O=12OH-;为了增大溶液的导电性且又不对其电池反应式造成影响而选择氯化钠。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做( )
A. 阴极 B. 阳极 C. 正极 D. 负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 碳酸钠的水溶液呈碱性,医学上能用于治疗胃酸过多
B. 含有铝元素的盐的水溶液一定显酸性
C. 钢铁在焊接前可以用NH4C1溶液的酸性消除表面的铁锈
D. SO2和乙烯均能使溴水褪色,其原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在透明溶液中能大量共存的一组离子是
A. Na+、Cl-、ClO-、I- B. Fe3+、Mg2+、Cl-、NO3-
C. NH4+、H+、S2-、NO3- D. H+ 、Ba2+、F-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物若完全燃烧生成CO2和H2O,或不完全燃烧生成CO、CO2、H2O。则此有机物含有元素的组成情况 (填元素符号)。
(2)某有机物ag与0.8mol O2在密闭容器中充分混合后点燃。待充分反应后,将产物中的H2O(g)和其它气态产物先缓慢通过足量澄清石灰水,产生40g白色沉淀,溶液质量减少0.8g。余下气体通过浓硫酸干燥后,再缓慢通过足量灼热CuO,固体由黑变红。将产生的气体又缓慢通过足量过氧化钠,充分反应后固体质量增加11.2g且只有氧气放出(假设每一步都充分反应或吸收)。请回答下列问题:
①通过计算确定该有机物化学式为 。
②若ag该有机物恰好与18.4g金属钠完全反应,试确定该有机物的结构简式 。
③若0.4mol该有机物恰好与9.2g金属钠完全反应,试确定该有机物的结构简式 。
(已知① 醚不与钠反应 ②一个碳原子上同时连2个或多个羟基是不稳定的)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:
(2)已知燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-= CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(3)随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
(4)通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧无汞碱性锌锰电池可用于制造隐形战机的机身涂料MnxZn(1-x)Fe2O4,该电池工作反应原理为Zn+2MnO2+2H2O![]() 2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:
2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:
A.浸取:将去除表面塑料的旧电池加入水中浸取并过滤,滤液经操作a得KOH固体;
B.溶液:滤渣中加入过量稀硫酸和足量双氧水,至不再出现气泡时,过滤;
C.测成分:测步骤B中滤液成分,然后加入铁粉;
D.氧化:加入双氧水氧化;
E.调pH:滴加氨水调pH,经结晶处理得MnxZn(1-x)Fe2O4。
(1)浸取时的操作有 ______。
A.拆解、粉碎旧电池 B.降低温度 C.搅拌 D.加压
(2)操作a为________。
(3)溶渣时生成Mn2+的主要离子方程式为______________________________。
(4)若步骤C测得滤液中金属离子组成为:c(Mn2+) +c(Zn2+) =0.8mol/L, c(Fe2+ ) = 0. 1 mol/L。若滤液体积为lm3,要合成MnxZn(1-x)Fe2O4,需加入Fe粉质量为___________kg(忽略体积变化)。
(5)氧化时,因为分解所需双氧水的量比理论值大得多。其原因可能是①温度过高;②______。
(6)最后一步结晶时,处理不当易生成MnFe2O4和ZnFe2O4。要制得MnxZn(1-x)Fe2O4,最后一步结晶时需注意______________________。
(7)某小组构想用ZnSO4、MnSO4溶液为原料,以Fe作电极用电解法经过一系列步骤制得MnxZn(1-x)Fe2O4,则开始电解时阳极反应式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
①NaCN+HNO2![]() HCN+NaNO2
HCN+NaNO2
②NaCN+HF![]() HCN+NaF
HCN+NaF
③NaNO2+HF![]() HNO2+NaF
HNO2+NaF
由此可判断下列叙述不正确的是 ( )
A.K(HCN)=7.2×10-4
B.K(HCN)<K(HF)<K(HNO2)
C.同浓度的三种盐溶液,pH(NaNO2)<pH(NaF)<pH(NaCN)
D.若已知酸性:CH3COOH<HNO2,则可以发生反应HF+CH3COONa![]() NaF+CH3COOH
NaF+CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎,下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
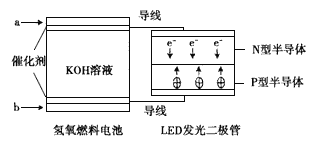
A.电池负极电极反应式为H2-2e-+2OH-=2H2O
B.a处通入氧气,b处通入氢气
C.该装置中能量转化只涉及两种形式的能量
D.P一型半导体连接的是电池负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com