
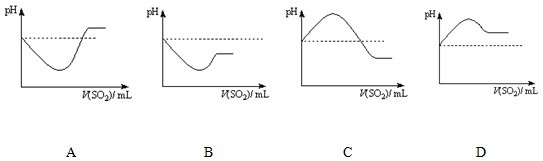
A.分散质粒子直径都在1 ~100 nm之间
B.都具有丁达尔效应
C.都比较稳定,密封保持一段时间也不会产生沉淀
D.加入NaOH,均先出现红褐色沉淀后沉淀溶解
科目:高中化学 来源: 题型:阅读理解
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |
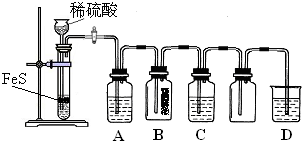
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
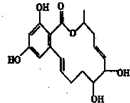 间苯二酚大环内酯具有较强的抗癌活性,其结构简式如图.下列有关间苯二酚大环内酯的说法不正确的是( )
间苯二酚大环内酯具有较强的抗癌活性,其结构简式如图.下列有关间苯二酚大环内酯的说法不正确的是( )| A、能使酸性KMnO4溶液褪色 | B、能与FeCl3溶液发生显色反应 | C、能与浓溴水发生加成反应和取代反应 | D、属于油脂类化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com