


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某工厂废渣含MgCO3、SiO2、Fe2O3 、FeCO3和CaCO 3 、Al2O3 。科研小组拟对废渣进行综合利用制取氢氧化镁、芒硝(Na2SO4·10H2O)和硫酸铝,设计如下工艺:
 |
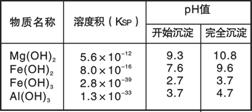 右表为几种沉淀的相关数据。回答以下问题:
右表为几种沉淀的相关数据。回答以下问题:
(1)滤渣Ⅰ中主要成分是CaSO4和
(填化学式)。
(2)欲检验滤液Ⅰ中是否含有Ca2+,
能否用碳酸钠溶液? (填“行”或“不行”)。
(3)滤液Ⅰ中加入试剂后,pH必须控制为9.0。如果pH过大,可能引起的后果是 。
(4)用化学方程式表示往滤液I中加入H2O2的目的
(5)滤液Ⅱ中c(Fe3+)= 。
(6)滤液Ⅲ的主要阳离子是____________(填离子符号);欲从滤液Ⅲ中分离出硫酸铝溶液,依次加入的试剂可以是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com