
【题目】工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、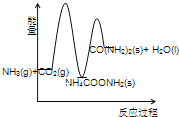 B、
B、
C、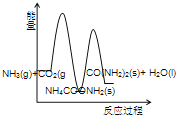 D、
D、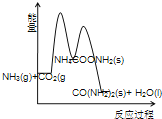
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
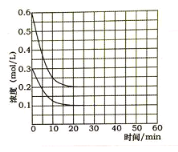
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
【答案】分子 2s22p3 氧元素和碳元素同周期,电子层数相同,氧元素的核电荷数比碳元素多,吸引电子能力强,因此非金属性比碳强 C 1/[c2(NH3)c(CO2)] 0.01 mol/(L·min) a 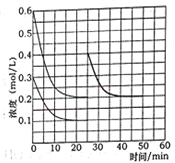
【解析】
(1)干冰,属于熔、沸点较低的分子晶体;氮原子原子序数为7,位于周期表第二周期ⅤA族;
(2)同周期元素从左到右,随着核电荷数递增,原子半径减小,吸引电子能力依次增强,非金属性依次增;
(3)根据反应物和生成物的能量高低与反应吸放热之间的关系来判断;
(4)依据化学平衡常数表达式=生成物平衡浓度系数次幂的乘积反应物平衡浓度系数次幂的乘积来书写;
(5)由氨气和二氧化碳的物质的量比为2:1,结合各物质浓度的变化曲线可知,起始时c(NH3)和c(CO2)分别为0.6mol/L和0.3mol/L,平衡时c(NH3)和c(CO2)分别为0.2mol/L和0.1mol/L。
①根据化学反应速率等于单位时间内物质浓度的变化量来计算;
②根据影响化学平衡移动的因素来回答判断;
③根据等效平衡知识来作图。
(1)固体CO2称干冰,属于熔、沸点较低的分子晶体;氮原子原子序数为7,位于周期表第二周期ⅤA族,最外层电子排布式是2s22p3,故答案为:分子;2s22p3;
(2)氧元素和碳元素均为第二周期元素,同周期元素从左到右,随着核电荷数递增,原子半径减小,吸引电子能力依次增强,非金属性依次增强,故答案为:氧元素和碳元素同周期,电子层数相同,氧元素的核电荷数比碳元素多,吸引电子能力强,因此非金属性比碳强;
(3)由题意可知,合成尿素的反应和反应①为放热反应,反应物的总能量高于生成物的总能量;反应②为吸热反应,反应物的总能量低于生成物的总能量。
A、合成尿素的反应为放热反应,2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
B、反应②为吸热反应,NH4COONH2 (s) 的总能量低于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
C、合成尿素的反应和反应①为放热反应,反应②为吸热反应,则2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,NH4COONH2 (s) 的总能量低于 CO(NH2)2(l)+H2O(l)的总能量,故正确;
D、合成尿素的反应为放热反应,2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
故选C,故答案为:C;
(4)反应①中为NH4COONH2固体,则化学平衡常数K=1/[c2(NH3)c(CO2)],故答案为:1/[c2(NH3)c(CO2)];
(5)①从反应开始至20min时,二氧化碳浓度变化量△c(CO2)=(0.3mol/L—0.1mol/L)=0.2mol/L,则v c(CO2)= △c(CO2)/ △t=0.2mol/L/20min=0.01 mol/(L·min),故答案为:0.01 mol/(L·min);
②该反应为气体体积减小的放热反应,缩小反应容器的容积,压强增大,平衡右移,尿素的产率增大;升高温度,平衡左移,尿素的产率减小;增加反应物的量,平衡右移,但尿素的产率不一定增大;使用合适的催化剂,平衡不移动,尿素的产率不变,故选a,故答案为:a;
③25min 时再向容器中充入2mol氨气和1mol二氧化碳,体系中c(NH3)和c(CO2)分别变为0.4mol/L和0.2mol/L,40min时重新达到平衡,由于建立的是等效平衡,氨气的平衡浓度保持不变,故图示为: ,故答案为:
,故答案为: 。
。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)可抑制金属腐蚀。以钼精矿(主要成分为MoS2,含少量杂质)为原料,制备钼酸钠晶体的主要流程图如下图。

回答下列问题
(1)完成下列反应:_____MoS2+ _____O2![]() _____SO2+ _____MoO3
_____SO2+ _____MoO3
在焙烧炉中,空气从炉底进入矿石经粉碎后从炉顶进入,这样处理的目的是_____________。
(2)浓氨水浸取粗产品获得(NH4)2MoO4溶液,其化学反应方程式为___________;该反应说明MoO3______(填“有”或“没有”)酸性氧化物的性质。
(3)常温下,沉钼阶段所得废液为(NH4)2SO4稀溶液。若(NH4)2SO4稀溶液的pH=a,则![]() =_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,
=_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,![]() 将_________(填“变大”“不变”或“变小”)。
将_________(填“变大”“不变”或“变小”)。
(4)操作X为_________________ ,已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X中应控制温度的最佳范围为________________。
温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 | ||||||
溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 |
| |
结晶得到的母液可以在下次结晶时重复使用,但达到一定次数后必须净化处理,原因是___。
(5)Li、MoS2 可充电电池的工作原理为![]() [Lix(MOS2)n附着在电极上],则电池充电时阳极的电极反应式为_________________________ 。
[Lix(MOS2)n附着在电极上],则电池充电时阳极的电极反应式为_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】698 K时,向V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。

请回答下列问题:
(1)V=________;反应从开始到平衡时,这段时间内平均反应速率v(HI)=_______。
(2)下列说法中可以说明反应2HI(g) H2(g)+I2(g)已达到平衡状态的是___。
A.单位时间内生成n mol H2的同时生成2n mol HI
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(3)当反应H2(g)+I2(g) 2HI(g)达到平衡状态时,_____(填“吸收”或“放出”)的热量为___。
(4)恒容下,某时刻加入HI(g),HI(g)的转化率_______(填“增大”、“减小”、“不变”)。
(5)压缩体积,平衡向________移动(填“正反应”、“逆反应”、“不”),气体颜色_______(填“变深”、“变浅”、不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌棒、铁棒和硫酸铜溶液组成原电池,正极上发生的反应为( )
A. Fe-2e-===Fe2+B. Cu2++2e-===Cu
C. Fe-3e-===Fe3+D. Zn-2e-===Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
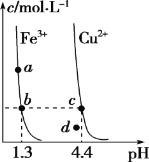
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. 在b、c两点代表的溶液中Fe(OH)3、Cu(OH)2分别达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列8种晶体,用序号回答下列问题:
A.水晶 B.白磷 C.冰醋酸 D.固态氩 E.氯化铵 F.铝 G.金刚石
(1)含有非极性键的原子晶体是_________ ,属于原子晶体的化合物是_______,不含化学键的分子晶体是 _______,属于分子晶体的单质是_________
(2)含有离子键、共价键、配位键的化合物是___________,受热熔化,需克服共价键的是___________.
(3)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有_____个硅原子,______个碳原子;金刚石熔点高于金刚砂的原因_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水.请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________。
(2)④、⑤、⑥、⑦四种溶液中NH![]() 浓度由大到小的顺序是(填序号)_______________。
浓度由大到小的顺序是(填序号)_______________。
(3)将③和④按体积比1∶2混合后,混合液中各离子浓度由大到小的顺序是:__________________。
(4)已知t ℃时,KW=1×10-13,则t ℃(填“>”、“<”或“=”)________25℃。在t ℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com