
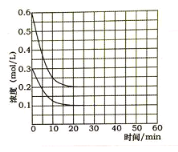
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
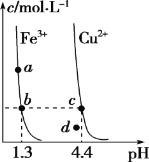
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. 在b、c两点代表的溶液中Fe(OH)3、Cu(OH)2分别达到饱和
【答案】B
【解析】
根据图象找出可用来比较Fe(OH)3、Cu(OH)2溶度积常数点,可用b、c进行计算;由a点变到b点,PH增大,氯化铵水解呈酸性,不会增大溶液的PH;Kw只与温度有关;注意分析处在曲线上的点与曲线外的点有什么区别。
A项,b点pH=1.3,c(OH-)=10-12.7mol/L,有Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=(10-12.7)3 c(Fe3+),c点时pH=4.4,c(OH-)=10-9.6mol/L,有Ksp[Cu(OH)2]=c(Cu2+)× c2(OH-)=(10-9.6)2 c(Cu2+),溶液在b、c两点时c(Fe3+)= c(Cu2+),可知Ksp[Fe(OH)3]<Ksp[Cu(OH)2],故A正确;
B项,溶液由a点变到b点即溶液pH变大,但由于铵根离子在溶液中会水解而显酸性,向溶液中加入适量氯化铵会使溶液pH值变小,因此不能使溶液由a点变到b点,故B错误;
C项,因为温度不变,所以该溶液中c(H+)与c(OH-)的乘积,即水的离子积常数KW不变,故C正确;
D项,b、c两点均在沉淀溶解平衡曲线上,因此这时的溶液均达到饱和,故D项正确。
综上所述,本题选B。


科目:高中化学 来源: 题型:
【题目】阿司匹林( )是常用的解热镇痛药,下列说法不正确的是( )
)是常用的解热镇痛药,下列说法不正确的是( )
A. 分子中含有两种含氧官能团
B. 阿司匹林与 互为同分异构体
互为同分异构体
C. 阿司匹林可以发生取代反应、加成反应、酯化反应
D. 1 mol阿司匹林可以与5mol H2发生加成反应,也可与1 mol碳酸氢钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.垃圾是放错地方的资源,应分类回收利用
B.实现化石燃料清洁利用,就无需开发新能源
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.为提高农作物的产量和质量,应大量使用化肥和农药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,RSO4(s)+CO32-(aq)![]() RCO3(s)+SO42-(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是
RCO3(s)+SO42-(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是
A. 向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RSO4沉淀
B. 将浓度均为6×10-6mol/L的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C. 25℃时,RSO4的Ksp约为4.9×10-5
D. 相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、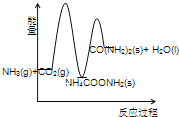 B、
B、
C、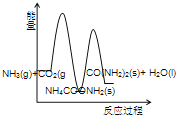 D、
D、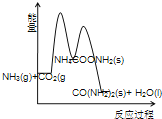
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,苯的化学性质比较稳定,这是因为( )
A. 苯不能使酸性高锰酸钾溶液褪色
B. 苯不与溴水发生加成反应
C. 苯的分子结构决定的
D. C—C键和C===C键交替形成苯环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用如下的方法从海水中提溴:
浓缩海水![]() 粗产品溴
粗产品溴![]() 溴蒸气
溴蒸气![]() 物质X
物质X ![]() 产品溴
产品溴
完成下列填空:
(1)上述流程中有两步都涉及到氯气。氯气分子中所含的化学键名称是:_____,溴单质的电子式是_________,溴和氯气态氢化物的沸点比较:___________>___________(填写化学式),写出一种含氯元素的化合物且属于非极性分子的化学式_____。
(2)步骤②中体现了溴单质具有的性质是_____。
(3)写出步骤③中反应的化学方程式并标出电子转移的方向和数目。(说明:反应有水参与且有硫酸生成):_____;在该反应中被氧化的元素是:_____。
(4)工业上利用海水还有一个重要的反应就是电解饱和食盐水,此反应中的阴极产物是:_____和______________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一密闭容器中充入NO2在一定条件下进行反应 2NO2(g) ![]() 2NO(g)+O2(g),该反应达到平衡状态的标志是( )
2NO(g)+O2(g),该反应达到平衡状态的标志是( )
A. NO2的生成速率等于NO的消耗速率
B. NO2和O2的浓度之比等于2:1
C. 容器内压强不再随时间变化而变化
D. v(NO):V(O2)=2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com