
【题目】化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.垃圾是放错地方的资源,应分类回收利用
B.实现化石燃料清洁利用,就无需开发新能源
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.为提高农作物的产量和质量,应大量使用化肥和农药
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)对于Fe+2HCl===FeCl2+H2↑,改变下列条件对生成氢气的速率有何影响?(填“增大”、“减小”或“不变”)
①升高温度:________;
②增加盐酸体积:____________;
③加入等体积的NaCl溶液:__________;
④滴入几滴CuSO4溶液:____________;
(2)一定温度下,反应N2(g)+O2(g) ===2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响。(填“增大”、“减小”或“不变”)
①缩小体积使压强增大:__________;
②恒容充入N2:__________;
③恒压充入He:__________。
(3)可逆反应A(g)+B(g) C(g)+D(g)。判断该反应是否达到平衡的依据为__________(填正确选项前的字母)
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
①从反应开始到10 s时,用Z表示的反应速率为________,X的物质的量浓度减少了________,Y的转化率为________。
②该反应的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铬(CrN)是一种良好的耐磨材料,实验室可用无水氯化铬(CrCl3)与氨气在高温下反应制备,反应原理为CrCl3+NH3![]() CrN+3HCl。无水氯化钙对氨气具有突出的吸附能力,其吸附过程中容易膨胀、结块。回答下列问题:
CrN+3HCl。无水氯化钙对氨气具有突出的吸附能力,其吸附过程中容易膨胀、结块。回答下列问题:
(1)制备无水氯化铬。氯化铬有很强的吸水性,通常以氯化铬晶体(CrCl3·6H2O)的形式存在。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为___________________________。以氯化铬晶体制备无水氯化铬的方法是_________________________________。
(2)制备氮化铬。某实验小组设计制备氮化铬的装置如下图所示(夹持与加热装置省略):

①装置A中发生反应的化学方程式为____________________________________________。
②实验开始时,要先打开装置A中活塞,后加热装置C,目的是______________________。
③装置B中盛放的试剂是___________,装置D的作用是______________________。
④有同学认为该装置有一个缺陷,该缺陷是______________________。
(3)氮化铬的纯度测定。制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为___________。
(4)工业上也可用Cr2O3与NH3在高温下反应制备CrN。相关反应的化学方程式为___________,提出一条能降低粗产品中氧含量的措施:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】698 K时,向V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。

请回答下列问题:
(1)V=________;反应从开始到平衡时,这段时间内平均反应速率v(HI)=_______。
(2)下列说法中可以说明反应2HI(g) H2(g)+I2(g)已达到平衡状态的是___。
A.单位时间内生成n mol H2的同时生成2n mol HI
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(3)当反应H2(g)+I2(g) 2HI(g)达到平衡状态时,_____(填“吸收”或“放出”)的热量为___。
(4)恒容下,某时刻加入HI(g),HI(g)的转化率_______(填“增大”、“减小”、“不变”)。
(5)压缩体积,平衡向________移动(填“正反应”、“逆反应”、“不”),气体颜色_______(填“变深”、“变浅”、不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种浓差电池的装置如下图所示,碱液室中加入电石渣浆液[主要成分为Ca(OH)2],酸液室通入CO2(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述错误的是( )

A. 电子由M极经外电路流向N极
B. N电极区的电极反应式为2H++2e-=H2↑
C. 在碱液室可以生成 NaHCO3、Na2CO3
D. 放电一段时间后,酸液室溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌棒、铁棒和硫酸铜溶液组成原电池,正极上发生的反应为( )
A. Fe-2e-===Fe2+B. Cu2++2e-===Cu
C. Fe-3e-===Fe3+D. Zn-2e-===Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
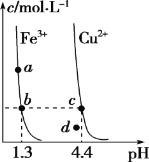
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. 在b、c两点代表的溶液中Fe(OH)3、Cu(OH)2分别达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断错误的是

A.根据阿伏加德罗常数可推知,1个乙分子中含有2个A原子
B.该反应类型是复分解反应
C.反应生成的丙物质属于单质
D.化学反应中分子的种类发生了改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com