
【题目】如图1是部分短周期元素的常见化合价与原子序数的关系图: 
(1)元素F在周期表中的位置 .
(2)C与D形成原子个数比为1:1的化合物中所含化学键类型为 .
(3)C、D、G对应的简单离子半径由大到小顺序是 . (用离子符号回答)
(4)某同学设计实验装置如图2,证明A、B、F的非金属性强弱关系:
①溶液a和溶液b分别为 , .
②溶液c中的离子反应方程式为 .
【答案】
(1)第三周期ⅣA族
(2)离子键、非极性共价键
(3)S2﹣>O2﹣>Na+
(4)硝酸;饱和NaHCO3溶液;SiO32﹣+CO2+H2O=H2SiO3↓+CO32﹣或SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣
【解析】解:短周期元素中,A、F均有+4、﹣4价,处于ⅣA族,且原子序数A<F,故A为碳、F为Si;C、G均有﹣2价,且G有+6,G的原子序数较大,故C为O元素、G为S元素;B有+5、﹣3价,原子序数介于碳、氧之间,故B为N元素;H有+7、﹣1价,原子序数大于硫,则H为Cl;D有+1价,E有+3价,分别处于ⅠA族、ⅢA族,原子序数氧<D<E<Si,故D为Na,E为Al.
(1.)元素F为Si,在周期表中的位置:第三周期ⅣA族,所以答案是:第三周期ⅣA族;
(2.)O与Na形成原子个数比为1:1的化合物是过氧化钠,过氧化钠中所含有离子键、非极性共价键,所以答案是:离子键、非极性共价键;
(3.)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越小,简单离子半径大小顺序是:S2﹣>O2﹣>Na+ , 所以答案是:S2﹣>O2﹣>Na+;
(4.)利用最高价含氧酸的酸性强弱,证明A、B、F的非金属性强弱关系,溶液a为硝酸,溶液b为饱和NaHCO3溶液,溶液c为硅酸钠溶液,溶液c中的离子反应方程式为:SiO32﹣+CO2+H2O=H2SiO3↓+CO32﹣或SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣ ,
所以答案是:①硝酸;饱和NaHCO3溶液;②SiO32﹣+CO2+H2O=H2SiO3↓+CO32﹣或SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣ .


科目:高中化学 来源: 题型:
【题目】下列反应中,因为反应条件改变,反应产物可以不同的是( )
A. 钠与氧气反应 B. 稀盐酸和硝酸银溶液
C. 铁在氯气中燃烧 D. 一氧化碳在氧气中燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能与盐酸反应又能与氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④NaAlO2 ⑤Na2CO3 ⑥Al
A. ②③⑤ B. ①②③④ C. ①②③⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的说法不正确的是( )
A.甲烷分子具有正四面体结构
B.甲烷分子中的四个C﹣H键是完全等价的
C.甲烷分子是平面正方形结构
D.甲烷分子的结构式是 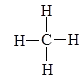
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,盐酸与氢氧化钠溶液相互滴定的滴定曲线如下图,下列叙述不正确的是
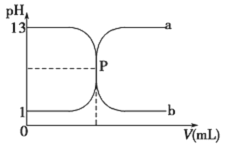
A. 滴定过程的任何时刻都存在:c(H+)+ c(Na+)=c(OH-)+c(Cl-)
B. 曲线b是用氢氧化钠溶液滴定盐酸溶液的滴定曲线
C. 氢氧化钠溶液的物质的量浓度为0.1molL-1
D. P点时恰好完全中和,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 温度控制在500℃有利于合成氨反应
B. 用排饱和食盐水法收集Cl2
C. 打开碳酸饮料会有大量气泡冒出
D. 工业制取金属钾Na(l)+KCl(l) ![]() NaCl(l)+K(g)选取适宜的温度,使钾变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使钾变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A2(g)+3B2(g)=2C(g)+D(g)来说在四种不同情况下的反应速率分别为:
①v(A)=0.15mol/(Ls)
②v(B)=0.6mol/(Ls)
③v(C)=0.5mol/(Ls)
④v(D)=0.45mol/(Ls)
则反应进行由快到慢的顺序为( )
A.④>③>①>②
B.④>③>②>①
C.②>③>④>①
D.②>④>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下

请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO( g) ![]() N2( g)+2CO2(g) △H=___________kJ·mol—1
N2( g)+2CO2(g) △H=___________kJ·mol—1
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图符合题意的是 ___(填选项序号)。(下图中V正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)

(2)在t1℃下,向体积为10 L的恒容密闭容器中通入NO和CO,测得不同时间NO和CO的物质的量如下表:

t1℃时该反应的平衡常数K= _______,既能增大反应速率又能使平衡正向移动的措施是
____。(写出一种即可)
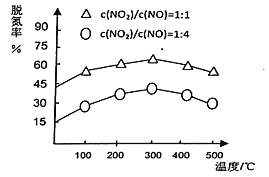
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/C(NO)、不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响____________________,给出合理的解释:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com