
【题目】TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,M=240g/mol。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
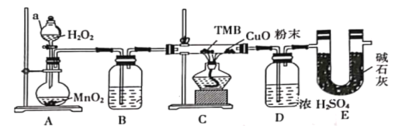
(1)写出仪器a的名称__________,A中的化学反应方程式:___________;
(2)B中试剂是___________,作用是________________ ;
(3)装置C中CuO粉末的作用为________________。
(4)理想状态下,将4.80 gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60 g,E增加14.08 g,则TMB的分子式为____________。
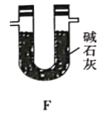
(5)有同学认为,用该实验装置测得的TMB分子式不准确,应在干燥管E后再添加一个装有碱石灰的干燥管F。你认为是否需要添加F装置__________(填“需要”或“不需要”),简述理由________________。
【答案】分液漏斗 ![]() 浓硫酸 干燥 O2,防止将水蒸气带入 D或E 中引起增重 使TMB不充分燃烧生成CO全部转化为CO2 C16H20N2 需要 防止外界空气中的 CO2 和 H2O 进入 E 中,避免对 E 处吸收二氧化碳的定量检测造成干扰
浓硫酸 干燥 O2,防止将水蒸气带入 D或E 中引起增重 使TMB不充分燃烧生成CO全部转化为CO2 C16H20N2 需要 防止外界空气中的 CO2 和 H2O 进入 E 中,避免对 E 处吸收二氧化碳的定量检测造成干扰
【解析】
由实验装置可知,A中过氧化氢在二氧化锰催化作用下生成氧气,B中浓硫酸干燥氧气,C中氧气将TMB氧化为二氧化碳、水和氮气,D中浓硫酸增重为水的质量,E中增重为二氧化碳的质量,结合质量及物质的量计算TMB分子中碳、氢、氮的原子个数比,根据相对分子质量之比算出相对分子质量,结合原子个数比计算出分子式,有必要在干燥管E后再添加一个装有碱石灰的干燥管F,防止空气中的水和二氧化碳进入E,以此解答该题。
(1)由装置图可知,仪器a为分液漏斗, A中发生H2O2在MnO2催化下分解制备氧气,故化学反应方程式为![]() ,故答案为:分液漏斗;
,故答案为:分液漏斗;![]() ;
;
(2)B 中试剂是浓硫酸,作用是干燥O2,防止带入 D或E 中引起增重,故答案为:浓硫酸;干燥O2,防止将水蒸气带入 D或E 中引起增重;
(3)装置C中CuO粉末的作用为使TMB不充分燃烧生成的CO全部转为CO2,故答案为:使TMB不充分燃烧生成CO全部转化为CO2;
(4)实验后称得D、E装置分别增加3.60g、14.08g,则m(H2O)=3.60g,m(CO2)=14.08g,则![]() ,n(H)=2n(H2O)=0.4mol;
,n(H)=2n(H2O)=0.4mol;![]() ,n(C)=n(CO2)=0.32mol;
,n(C)=n(CO2)=0.32mol;
所以![]() ;
;
则:n(C):n(H):n(N)=0.32mol:0.4mol:0.04mol=8:10:1,
TMB的相对分子质量为240,设分子式为C8nH10nNn,则有12×8n+10n+14n=240,解得n=2,所以分子式为C16H20N2,故答案为:C16H20N2;
(5)本实验是通过TMB完全燃烧,并利用D、E装置分别吸收H2O和CO2来确定其分子组成,若不添加F装置,外界空气中的CO2和H2O进入E中,从而干扰 E处吸收二氧化碳的定量检测,给实验造成误差,故答案为:需要;防止外界空气中的CO2和H2O进入E 中,避免对 E 处吸收二氧化碳的定量检测造成干扰。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中可能大量共存的是
A.澄清透明的溶液中: Fe3+、Mg2+、SCN-、Cl-
B.由水电离产生的c(H+)= 10-13mol/L 的溶液: K+、Na+、CH3COO-、![]()
C.c(Fe2+)= 1mol/L的溶液中: H+、![]() 、
、![]() 、
、![]()
D.pH=1的溶液中: Ba2+、Mg2+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】来自植物精油中的三种活性成分的结构简式如下。下列说法正确的是
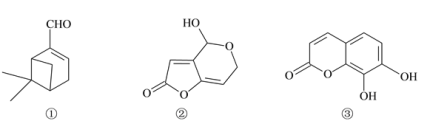
A.①中含有2个手性碳原子数
B.②难溶于水,分子中含有3种官能团
C.1 mol②、③与浓溴水反应,最多消耗2 mol Br2
D.1 mol③最多可与3 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖B. 可采取分液的方法分离乙醇和水
C. 可用碘水检验淀粉是否完全水解D. 葡萄糖可以在酒曲酶作用下分解生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]()
B.pH=12的溶液中:OH-、K+、Cl-、HCO![]()
C.加入铝粉能放出氢气的溶液中一定存在:NH![]() 、NO
、NO![]() 、AlO
、AlO![]() 、SO
、SO![]()
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.甲苯既可使溴的CCl4溶液褪色,也可使KMnO4酸性溶液褪色
B.有机物![]() 的消去产物有2种
的消去产物有2种
C.鉴别乙醇和苯:将少量的酸性KMnO4溶液分别滴入少量的乙醇和苯中
D.有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CHCOOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,22.4 L Cl2溶于水充分反应转移NA个电子
B. 标准状况下,2.24 L HF与1.6 g CH4分子所含电子数目均为NA
C. 50 g质量分数为46%的乙醇溶液中氢原子总数为6NA
D. 25 ℃时,1 L 2 mol/L NH4Cl溶液和1 L 1 mol/L (NH4)2SO4溶液中所含NH4+的数目均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,人们对环境保护、新能源开发非常重视。
(1)已知:①CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJmol1
N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJmol1
②2NO2(g)![]() N2O4(g)ΔH2=-66.9kJmol1
N2O4(g)ΔH2=-66.9kJmol1
写出CH4催化还原N2O4(g)生成N2、H2O(g)和CO2的热化学方程式_____________。
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
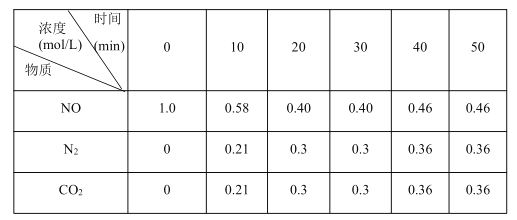
①根据表中数据分析,t1℃时,该反应在0~20min的平均反应速率v(NO)=_____________,该反应的平衡常数K=_____________。
②30min时,只改变某一条件,根据上表中的数据判断改变的条件可能是_____________(填字母代号)。
A.适当缩小容器的体积B.加入合适的催化剂
C.加入一定量的活性炭D.通入一定量的NO
③若30min后升高温度至t2℃,达到平衡时,容器中NO、N2、CO的浓度之比为5∶3∶3,则达到新平衡时NO的转化率_____________(填“升高”或“降低”);ΔH_____________0(填“>”或“<”)。
(3)①已知在一定温度下,反应2NH3(g)+CO2(g)![]() H2NCOONH4(s)ΔH=159.5kJmol1,在2L恒容密闭容器中充入2molNH3和1molCO2,到达平衡时放出127.6kJ的热量,此时,c(NH3)为_____________。
H2NCOONH4(s)ΔH=159.5kJmol1,在2L恒容密闭容器中充入2molNH3和1molCO2,到达平衡时放出127.6kJ的热量,此时,c(NH3)为_____________。
②有一种可充电电池NaAl/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池负极电极反应式为Nae=Na+,则正极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用特殊电极材料制作的新型二次电池,放电时发生如下图所示的电极反应,下列说法正确的是
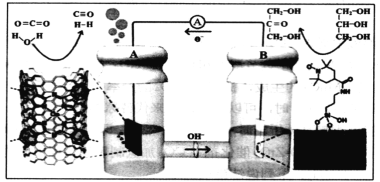
A.A为原电池的负极,失去电子,发生氧化反应
B.B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-=CH2OHCOCH2OH+2H+
C.若通过交换膜的离子是HCO![]() ,则B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-+2HCO
,则B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-+2HCO![]() =CH2OHCOCH2OH+2H2O+2CO2
=CH2OHCOCH2OH+2H2O+2CO2
D.若A处产生的CO和H2的物质的量之比为1:3,则B处消耗丙三醇的物质的量为4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com