
【题目】下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]()
B.pH=12的溶液中:OH-、K+、Cl-、HCO![]()
C.加入铝粉能放出氢气的溶液中一定存在:NH![]() 、NO
、NO![]() 、AlO
、AlO![]() 、SO
、SO![]()
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+
、K+
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】根据下列图示得出的结论不正确的是( )
A.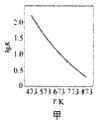 图甲是CO(g)+H2O(g)
图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
B.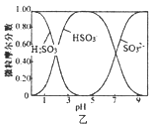 图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
C.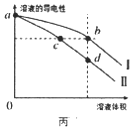 图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
D.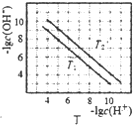 图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)下列基态原子或离子的价层电子排布图正确的_____________。
A ![]() B
B ![]()
C ![]() D
D ![]()
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的键角比水分子的______(填“大”或“小”)。
②X的沸点比水低的主要原因是___________。
(3)CuFeS2晶胞结构如图所示。
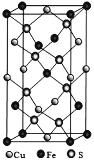
①Cu2+的配位数为__________,S2-的配位数为____________。
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是_______gcm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4与Cl2生成CH3Cl的反应过程中,中间态物质的能量关系如图所示(Ea表示活化能)。下列说法不正确的是
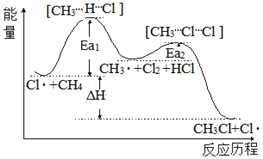
A.已知Cl是由Cl2在光照条件下化学键断裂生成的,该过程可表示为:![]()
B.相同条件下,Ea越大相应的反应速率越慢
C.图中ΔH<0,其大小与Ea1、Ea2无关
D.CH4+Cl2![]() CH3Cl+HCl是一步就能完成的反应
CH3Cl+HCl是一步就能完成的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
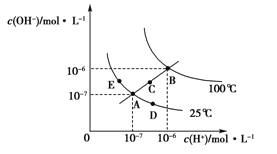
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量NaOH的方法
C. 若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
D. 若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,M=240g/mol。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
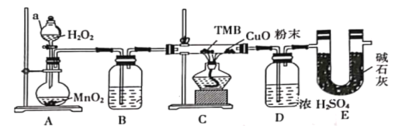
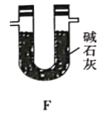
(1)写出仪器a的名称__________,A中的化学反应方程式:___________;
(2)B中试剂是___________,作用是________________ ;
(3)装置C中CuO粉末的作用为________________。
(4)理想状态下,将4.80 gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60 g,E增加14.08 g,则TMB的分子式为____________。
(5)有同学认为,用该实验装置测得的TMB分子式不准确,应在干燥管E后再添加一个装有碱石灰的干燥管F。你认为是否需要添加F装置__________(填“需要”或“不需要”),简述理由________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=______kJ·mol-1
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:
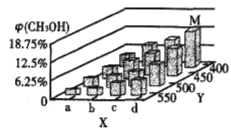
①图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________;
②若反应II的平衡常数K值变小,则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____;用H2表示I的反应速率为_____mol·L-1·min-1。
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(
)=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3BO3(一元弱酸)可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
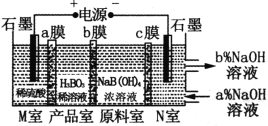
A.M室发生的电极反应式为:2H2O-4e-=O2↑+4H+
B.b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
C.理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
D.N室中:a%<b%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.下图为埋在地下的钢管道采用牺牲阳极保护法防腐
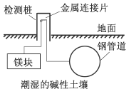
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.马口铁(镀锡铁)镀层破损后,被腐蚀时首先是镀层被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com