
| A. | 1s22s22p5 | B. | 1s22s22p43s2 | ||
| C. | 1s22s22p63s23p63d54s1 | D. | 1s22s22p63s23p63d34s2 |
分析 原子的核外电子排布符合基态原子核外电子填充的能级顺序和能量最低原理、泡利不相容原理及洪特规则,原子处于基态,否则为激发态,以此进行判断.
解答 解:A.电子排布式为1s22s22p5符合能量最低原理,所以为基态原子,故A不选;
B.电子排布式为1s22s22p43s2不符合能量最低原理,根据能量最低原理知,其基态应为1s22s22p6,故B选;
C.电子排布式为1s22s22p63s23p63d54s1符合能量最低原理,所以为基态原子,故C不选;
D.电子排布式为1s22s22p63s23p63d34s2符合能量最低原理,所以为基态原子,故D不选;
故选:B.
点评 本题考查原子核外电子的排布,侧重于激发态的判断,可根据能量最低原理进行判断,题目难度不大.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:推断题
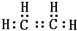 B的结构简式CH3CH2OH
B的结构简式CH3CH2OH查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
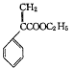 )是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )
)是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 1mol颠茄酸酯最多与4molBr2发生加成反应 | |
| C. | 能与NaHCO3溶液反应 | |
| D. | 能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
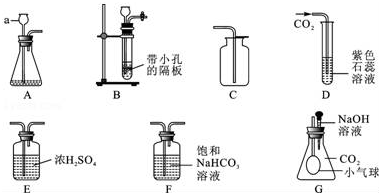
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) | ||
| C. | c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | D. | c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a≤100时,发生的离子反应为:OH-+H+=H2O | |
| B. | 当a≥300时,发生的离子反应为:OH-+3H++CO32-=2H2O+CO2↑ | |
| C. | 当100<a<200时,反应后的溶液中CO32-与HCO3-的物质的量之比为(a×10-4-0.01):(0.02-a×10-4) | |
| D. | 当a=200时,发生的离子反应为:OH-+2H++CO32-=H2O+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,Z与M最外层电子数相同,X与M在周期表中的位置如图:
W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,Z与M最外层电子数相同,X与M在周期表中的位置如图: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com