
【题目】(1)在25℃、101kPa下,1g甲醇(CH3OH,常温为液体)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________
(2)氨可用作碱性燃料电池的燃料,电池反应为 4NH3+3O2=2N2+6H2O,则氨燃料电池的负极电极反应为 ____________________.
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为___________________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=_____________________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)盐类水解在实际生产生活中有重要的用途.常用的泡沫灭火器就是利用了小苏打和硫酸铝溶液的反应原理来灭火,写出该反应的离子方程式:_________________
【答案】(1)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=–725.76kJ·mol-1
(2)6OH-+2NH3-6e-=N2+6H20
(3)①0.05mo1·L-1②1×10-11mo1/L)③2
(4)3HCO3-+Al3+==Al(OH)3↓+3CO2↑
【解析】
试题分析:(1)1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ,燃烧热热化学方程式为:CH3OH(l)+3/2O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJmol-1;
(2)原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为:2NH3+6OH--6e-=N2+6H2O;
(3)①pH=13的Ba(OH)2溶液,C(H+)=10-13mol/L,C(OH-)=![]() =10-1mol/L,则C(Ba(OH)2)=0.5×c(OH-)=0.05 molL-1;
=10-1mol/L,则C(Ba(OH)2)=0.5×c(OH-)=0.05 molL-1;
②pH=13的Ba(OH)2溶液稀释100倍后,pH=13-2=11,此时溶液中氢离子由水电离产生,水电离产生的c(H+)等于溶液中水电离出c(OH -),故水电离出c(OH -)=c(H+)=10-11mol/L;
③设盐酸的物质的量浓度为:C(HCl),碱与酸体积分别为1L、9L,则n(OH -)=0.1mol/L×1L=0.1mol,n(H+)=C(HCl)×9L,反应后剩余氢氧根离子的物质的量为:0.1mol-c(HCl)×9L;有混合所得溶液pH=11,可知混合后c(H+)=10-11 molL-1,则混合后c(OH -)=![]() =10-3 molL-1,即:
=10-3 molL-1,即:![]() =10-3 molL-1,解得:c(HCl)=10-2molL-1,pH=-lgc(H+),所以pH=2;
=10-3 molL-1,解得:c(HCl)=10-2molL-1,pH=-lgc(H+),所以pH=2;
(4)泡沫灭火器是利用HCO3-和Al3+的双水解反应,离子方程式为3HCO3-+Al3+==Al(OH)3↓+3CO2↑。


科目:高中化学 来源: 题型:
【题目】已知:①RNH2+R′CH2Cl![]() RNHCH2R′+HCl(R和R′代表烃基)
RNHCH2R′+HCl(R和R′代表烃基)
②苯的同系物能被高锰酸钾氧化,如: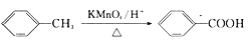
③
化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
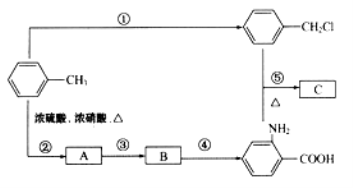
(1)B物质的结构简式是_____________.
(2)写出反应①、②的化学方程式:
①_____________________
②_____________________
(3)反应①~⑤中,属于取代反应的是_____________(填反应序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用如图所示装置进行实验。
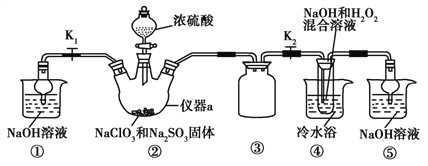
(1)仪器a的名称为____,装置①的作用是____,装置③的作用是______。
(2)装置②中产生ClO2,涉及反应的化学方程式为________________;装置④中反应生成NaClO2的化学方程式为_______________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③______;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水,_____________________。
(5)为了测定NaClO2粗品的纯度,取上述粗产品10.0 g溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00 mL,试计算NaClO2粗品的纯度_____。(提示:2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是 ( )
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,反应A2(g)+B2(g)![]() xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
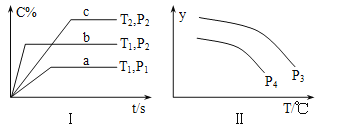
A. P3<P4,y为A2转化率
B. P3<P4,y为A2浓度
C. P3>P4,y为混合气密度
D. P3>P4,y为C的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年科学家首次利用X射线现测到化学反应过渡态的形成。在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是
A. CO与CO2均为酸性氧化物
B. 大量CO2的排放可导致酸雨的形成
C. CO与O形成化学键过程中有电子转移
D. 固体催化剂的使用会降低该反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离方法不正确的是 ( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com