
【题目】海藻中含有丰富的、以离子形式存在的碘元素。下图是实验室从海藻里提取碘的流程中的一部分。

下列判断正确的是
A. 步骤①③的操作分别是过滤、萃取
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤③中加入的有机溶剂是裂化汽油或乙醇
D. 步骤④的操作是过滤
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,可通过KClO溶液与Fe(NO3)3溶液的反应制备。
已知:①KClO在较高温度下发生歧化反应生成KClO3
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2,如图所示是实验室模拟工业制备KClO溶液装置。

(1)B装置的作用为______________________;
(2)反应时需将C装置置于冷水浴中,其原因为__________________;
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是________,制备K2FeO4的离子方程式_________________;
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,溶液中可能含有Fe2+,检验Fe2+所需试剂名称________,其反应原理为______________________(用离子方程式表示);
(5)向反应后的三颈瓶中加入饱和KOH溶液,析出K2FeO4固体,过滤、洗涤、干燥。洗涤操作所用最佳试剂为______________________;
A.水 B.无水乙醇 C.稀KOH溶液
(6)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:

①消耗Na2S2O3标准溶液的体积为____________mL。
②原样品中高铁酸钾的质量分数为_________________。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是( )
A.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH![]() Na2SiO3+H2O
Na2SiO3+H2O
B.红热的铁丝与水接触,表面形成黑色保护层:3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
C.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
D.“84”消毒液(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L容器中3种物质间进行反应,X,Y,Z的物质的量随时间的变化曲线如图,反应在t1 min时到达平衡,如图所示:

(1)该反应的化学方程式是_________。
(2)①若上述反应中X,Y,Z分别为NH3、H2、N2 , 且已知1mol 氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,该反应吸收的热量为_______;在此t1 min时间内,用H2表示反应的平均速率v(H2)为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用只含有铝、铁、铜的工业合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,其实验方案如图所示:

(1)合金与NaOH溶液反应的离子方程式为_________________________________________。
(2)方案中途径②的离子方程式________________________________________________,
D中加入适量盐酸的离子方程式为________________________________________________。
(3)滤渣F的主要成分为____________________
(4)CuSO4溶液中获得胆矾的操作为蒸发浓缩,_____________、过滤_,洗涤、自然干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是

A.2molCu与1 molAg2O的总能量低于1 molCu2O与2molAg具有的总能量
B.负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O
C.测量原理示意图中,电流方向从Cu流向Ag2O
D.电池工作时,OH-向Ag电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程不能达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 测定NaOH溶液的浓度 | 用酸式滴定管量取20.00mL待测NaOH溶液,用甲基橙作指示剂,用标准浓度的盐酸进行滴定 |
B | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
C | 加快铁片与盐酸的反应速率 | 向反应液中滴人几滴CuCl2溶液 |
D | 比较CdS(黄色)与CuS(黑色)的溶解度(已知 | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2+3H2 ![]() 2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
A. 降低体系温度能加快反应速率
B. 使用恰当的催化剂能加快反应速率,又能提高N2的转化率
C. 达到反应限度时各组分含量之比一定等于3∶1∶2
D. 若在反应的密闭容器加入1mol N2和过量的H2,最后不能生成2mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是: ,
,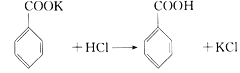 。已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃;苯甲酸的熔点为121.7℃,沸点为249℃,常温下,在水中的溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
。已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃;苯甲酸的熔点为121.7℃,沸点为249℃,常温下,在水中的溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:

试根据上述信息回答下列问题:
(1)操作I的名称是________,乙醚溶液中所溶解的主要成分是____________;
(2)操作Ⅱ的名称是________,产品甲是________。
(3)操作Ⅲ的名称是________,产品乙是________。
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是____(填“a”、“b”、“c” 或“d”),收集乙醚产品的适宜温度为___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com