
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщгУжЛКЌгаТСЁЂЬњЁЂЭЕФЙЄвЕКЯН№жЦШЁДПОЛЕФТШЛЏТСШмвКЁЂТЬЗЏОЇЬх(FeSO4ЁЄ7H2O)КЭЕЈЗЏОЇЬхЃЌЦфЪЕбщЗНАИШчЭМЫљЪОЃК

(1)КЯН№гыNaOHШмвКЗДгІЕФРызгЗНГЬЪНЮЊ_________________________________________ЁЃ
(2)ЗНАИжаЭООЖЂкЕФРызгЗНГЬЪН________________________________________________ЃЌ
DжаМгШыЪЪСПбЮЫсЕФРызгЗНГЬЪНЮЊ________________________________________________ЁЃ
(3)ТЫдќFЕФжївЊГЩЗжЮЊ____________________
(4)CuSO4ШмвКжаЛёЕУЕЈЗЏЕФВйзїЮЊеєЗЂХЈЫѕЃЌ_____________ЁЂЙ§ТЫ_ЃЌЯДЕгЁЂздШЛИЩдяЁЃ
ЁОД№АИЁП2AlЃЋ2OHЃЃЋ2H2O=2AlO2-ЃЋ3H2Ёќ AlO2-ЃЋCO2ЃЋ2H2O=Al(OH)3Ё§ЃЋHCO3- Al(OH)3ЃЋ3HЃЋ=Al3ЃЋЃЋ3H2O CuЛђЭЕЅжЪ РфШДНсОЇ
ЁОНтЮіЁП
КЌгаТСЁЂЬњЁЂЭЕФЙЄвЕКЯН№МгШызуСПЩеМюШмвККѓЙ§ТЫЕУЕНТЫвКAКЭТЫдќBЃЌТЫвКAЮЊЦЋТСЫсФЦШмвКЃЌЭЈЙ§ЭООЖЂйМгШызуСПбЮЫсЗДгІЩњГЩТШЛЏФЦЁЂТШЛЏФЦКЭЫЎЃЛЭЈЙ§ЭООЖЂкЭЈШызуСПФГЦјЬхКѓЙ§ТЫЕУЕНГСЕэDЃЌдђФГЦјЬхЮЊЖўбѕЛЏЬМЃЌГСЕэDЮЊAl(OH)3ЃЛТЫдќBЮЊЭКЭЬњЕФЛьКЯЮяЃЌМгШызуСПЯЁСђЫсКѓЙ§ТЫЕУЕНТЫвКEЮЊСђЫсбЧЬњШмвКЃЌПЩжЦБИТЬЗЏЃЛЕУЕНТЫдќFЮЊЭЃЌЭЭЈЙ§ЭООЖЂлМгШыХЈСђЫсЃЌМгШШжЦЕУСђЫсЭШмвКЃЛЛђЭЈЙ§ЭООЖЂмМгШыЯЁСђЫсМгШШВЂЭЈШыПеЦјвВПЩжЦЕУСђЫсЭШмвКЃЌСђЫсЭШмвКЭЈЙ§еєЗЂХЈЫѕЁЂРфШДНсОЇЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЕУЕНЕЈЗЏЃЌОнДЫЗжЮіЁЃ
(1)КЯН№КЌгаТСЁЂЬњЁЂЭЕФЙЄвЕКЯН№ЃЌжЛгаТСФмгыNaOHШмвКЗДгІЩњГЩЦЋТСЫсФЦКЭЧтЦјЃЌЗДгІЕФРызгЗНГЬЪНЮЊ2AlЃЋ2OHЃЃЋ2H2O=2AlO2-ЃЋ3H2ЁќЃЛ
(2)ЗНАИжаЭООЖЂкЭЈШызуСПФГЦјЬхКѓЙ§ТЫЕУЕНГСЕэDЃЌдђФГЦјЬхЮЊЖўбѕЛЏЬМЃЌГСЕэDЮЊAl(OH)3ЃЛЗДгІЕФРызгЗНГЬЪНЮЊAlO2-ЃЋCO2ЃЋ2H2O=Al(OH)3Ё§ЃЋHCO3-ЃЛ
DжаМгШыЪЪСПбЮЫсЗДгІЩњГЩТШЛЏТСКЭЫЎЃЌЗДгІЕФРызгЗНГЬЪНЮЊAl(OH)3ЃЋ3HЃЋ=Al3ЃЋЃЋ3H2OЃЛ
(3)ТЫдќFЕФжївЊГЩЗжЮЊCuЛђЭЕЅжЪЃЛ
(4)CuSO4ШмвКжаЛёЕУЕЈЗЏЕФВйзїЮЊеєЗЂХЈЫѕЁЂРфШДНсОЇЁЂЙ§ТЫЃЌЯДЕгЁЂздШЛИЩдяЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНќФъЮвЙњФГаЉГЧЪаЫсгъЮлШОНЯЮЊбЯжиЃЌжївЊЪЧвђЮЊДѓСПШМЩеКЌСђСПИпЕФУКЖјаЮГЩЕФЁЃ
ЪЕбщФПЕФЃКЭЈЙ§ЪЕбщжЄУїУКжаКЌгаЬМдЊЫиКЭСђдЊЫиЁЃ
ВщдФзЪСЯЃК
ЃЈ1ЃЉЁАЖўбѕЛЏСђФмЪЙИпУЬЫсМиШмвКЭЪЩЋЃЈгЩзЯКьЩЋБфЮЊЮоЩЋЃЉЃЌЧыЭъГЩИУЗДгІЕФРызгЗНГЬЪНЃК___ЁЃ
ЃЈ ЃЉSO2+ЃЈ ЃЉMnO4-+ЃЈ ЃЉ=ЃЈ ЃЉ+ЃЈ ЃЉMn2++ЃЈ ЃЉ
ИљОнЩЯЪізЪСЯЃЌМзЭЌбЇКЭБћЭЌбЇЗжБ№ЩшМЦЪЕбщЗНАИНјааЬНОПЁЃ
ЪЕбщЬНОПЃКМзЭЌбЇЃКМзЭЌбЇНјааСЫШчЭМЫљЪОAЁЂBСНВНЪЕбщЃК

ЁАЪЕбщЯжЯѓЁБЃКAжаЯЁИпУЬЫсМиШмвКЭЪЩЋЃЌBжаГЮЧхЪЏЛвЫЎБфЛызЧЁЃ
ЁАЕУГіНсТлЁБЃКУКШМЩеЩњГЩЖўбѕЛЏСђКЭЖўбѕЛЏЬМЃЌжЄУїУКжаКЌгаЬМдЊЫиКЭСђдЊЫиЁЃ
ЃЈ2ЃЉввЭЌбЇШЯЮЊМзЕФЗНАИВЛКЯРэЃЌЦфРэгЩЪЧ___ЃК
ЪЕбщЬНОПЃКБћЭЌбЇЃКБћЭЌбЇНјааСЫШчЭМЫљЪОЪЕбщЃЈВПЗжзАжУдкЭМжаТдШЅЃЉЃК

ЃЈ3ЃЉЭМCзАжУЕФзїгУЪЧ___ЁЃ
ЃЈ4ЃЉжЄУїУКжаКЌгаЬМдЊЫиКЭСђдЊЫиЕФЯжЯѓЪЧЃК___ЁЃ
ЃЈ5ЃЉзАжУCжаЕФИпУЬЫсМиШмвКвВПЩвдЬцЛЛЮЊ___ЁЃ
A.зуСПI2ЕФЕэЗлШмвК
B.зуСПБЅКЭNaHCO3ШмвК
C.зуСПNa2SO3ШмвК
D.зуСПфхЫЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌЯТСагаЙиа№Ъіе§ШЗЕФЪЧ(ЁЁЁЁ)
A.1.8 g NH4+жаКЌгаЕФЕчзгЪ§ЮЊ1.1NA
B.2.2 g CO2КЭN2OЕФЛьКЯЦјЬхжадзгЪ§ЮЊ0.15NA
C.1 mol Na2O2гызуСПCO2ЗДгІЃЌзЊвЦЕчзгЪ§ЮЊ2NA
D.25 ЁцЁЂ101 kPaЪБЃЌ2.24 L CH4КЌгаЕФжЪзгЪ§ЮЊ1NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПTЁцЪБЃЌЯђ2LКуШнУмБеШнЦїжаГфШы1mol NO2гы2mol SO2ЗЂЩњШчЯТЗДгІЃКNO2(g)+SO2(g) ![]() SO3(g)+NO(g)ЁїH=Љ41.8kJ/molЁЃ
SO3(g)+NO(g)ЁїH=Љ41.8kJ/molЁЃ
(1)ЯТСаФмЫЕУїИУЗДгІДяЕНЦНКтзДЬЌЕФЪЧ_____________ЁЃ
aЃЎЬхЯЕбЙЧПБЃГжВЛБф
bЃЎЛьКЯЦјЬхбеЩЋБЃГжВЛБф
cЃЎSO3КЭNOЕФЬхЛ§БШБЃГжВЛБф
dЃЎУПЯћКФn mol SO3ЕФЭЌЪБЩњГЩn mol NO2
(2)ЗДгІНјааЕН20s ЪБЃЌВтЕУЗДгІЫйТЪv(NO)=0.005mol/(Ls) ЃЌ дђЯћКФЕФNO2ЮЊ_____molЁЃ
(3)ЯТСаДыЪЉФмЪЙЗДгІМгПьЕФЪЧ___(НіИФБфвЛИіЬѕМў)
aЃЎНЕЕЭЮТЖШ bЃЎЫѕаЁШнЛ§ cЃЎЪЙгУаЇТЪИќИпЕФДпЛЏМС
(4)ШєЩЯЪіШнЦїЮЊОјШШШнЦї(гыЭтНчЮоШШНЛЛЛ)ЃЌдђЕНДяЦНКтЫљашЪБМфНЋ__________ЁЃ
aЃЎбгГЄ bЃЎЫѕЖЬ cЃЎВЛБф dЃЎЮоЗЈШЗЖЈ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊгаЛњЮяЗжзгжаЕФЬМЬМЫЋМќЗЂЩњГєбѕбѕЛЏЗДгІЃК ЃЌгаЛњЮяAЕФНсЙЙМђЪНЮЊ
ЃЌгаЛњЮяAЕФНсЙЙМђЪНЮЊ ЃЌGЕФЗжзгЪНЮЊC7H12OЃЌвдЯТAЁЋHОљЮЊгаЛњЮяЃЌЦфзЊЛЏЙиЯЕШчЯТЃК
ЃЌGЕФЗжзгЪНЮЊC7H12OЃЌвдЯТAЁЋHОљЮЊгаЛњЮяЃЌЦфзЊЛЏЙиЯЕШчЯТЃК

ЃЈ1ЃЉЯТСаЫЕЗЈе§ШЗЕФЪЧ ______ ЁЃЃЈЬюзжФИађКХЃЉ
AЃЎCЕФЙйФмЭХЮЊєШЛљ
BЃЎ1molAзюЖрПЩвдКЭ2molNaOHЗДгІ
CЃЎCПЩвдЗЂЩњбѕЛЏЗДгІЁЂШЁДњЗДгІКЭМгГЩЗДгІ
DЃЎ![]() ПЩвдЗЂЩњЯћШЅЗДгІ
ПЩвдЗЂЩњЯћШЅЗДгІ
ЃЈ2ЃЉFЕФНсЙЙМђЪНЮЊ____________ ЃЌгЩFЕНGЕФЗДгІРраЭЮЊ___________ ЁЃ
ЃЈ3ЃЉЗДгІЂйЕФзїгУЪЧ__________________ ЃЌКЯЪЪЕФЪдМСaЮЊ____________ЁЃ
ЃЈ4ЃЉЭЌЪБТњзуЯТСаЬѕМўЕФAЕФвЛжжЭЌЗжвьЙЙЬхЕФНсЙЙМђЪН______________________ЁЃ
ЂёЃЎгыAОпгаЯрЭЌЕФЙйФмЭХЃЛЂђЃЎЪєгкБНЕФСкЖўШЁДњЮяЃЛЂѓЃЎФмЪЙFeCl3ШмвКЯдЩЋЃЛЂєЃЎКЫДХЙВеёЧтЦзЗжЮіЃЌЗжзгжага8жжВЛЭЌЛЏбЇЛЗОГЕФЧтдзгЁЃ
ЃЈ5ЃЉHгыGЗжзгОпгаЯрЭЌЕФЬМдзгЪ§ФПЃЌЧв1molHФмгызуСПЕФаТжЦвјАБШмвКЗДгІЩњГЩ4molЕЅжЪвјЁЃаДГіHгызуСПЕФаТжЦвјАБШмвКЗДгІЕФЛЏбЇЗНГЬЪН__________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЃдхжаКЌгаЗсИЛЕФЁЂвдРызгаЮЪНДцдкЕФЕтдЊЫиЁЃЯТЭМЪЧЪЕбщЪвДгКЃдхРяЬсШЁЕтЕФСїГЬжаЕФвЛВПЗжЁЃ

ЯТСаХаЖЯе§ШЗЕФЪЧ
A. ВНжшЂйЂлЕФВйзїЗжБ№ЪЧЙ§ТЫЁЂнЭШЁ
B. ПЩгУЕэЗлШмвКМьбщВНжшЂкЕФЗДгІЪЧЗёНјааЭъШЋ
C. ВНжшЂлжаМгШыЕФгаЛњШмМСЪЧСбЛЏЦћгЭЛђввДМ
D. ВНжшЂмЕФВйзїЪЧЙ§ТЫ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋ3.84 gЕФЭМгШы100 mL H2SO4КЭHNO3ЛьКЯвКжаЃЌЭШЋВПШмНтВЂЗХГіЮоЩЋЦјЬхЁЃЯђШмвКжаМгШы2.70 gТСЗлЃЌГфЗжЗДгІКѓЙ§ТЫЃЌЕУЕНШмвКXЁЂТЫдќYКЭЦјЬхZЃЌЦјЬхZгіПеЦјВЛБфЩЋЃЌдкБъзМзДПіЯТЕФЬхЛ§ЮЊ672 mLЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ШмНтТСЗлЕФжЪСПЮЊ0.54 g
B. ТЫдќYжаПЩФмжЛКЌгаCu
C. дЛьКЯвКжаЕФc(H2SO4):c(HNO3)ЃН9:4
D. ШєЯђШмвКXжаМгШы100 mL 2.0 molЁЄLЃ1ЧтбѕЛЏФЦШмвКЃЌГфЗжЗДгІЃЌЫљЕУГСЕэЮЊ4.68 g
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввШВЁЂввЯЉОљЪЧживЊЕФЛЏЙЄдСЯЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉ1902ФъЃЌSabatierЪзДЮЗЂЯжЃЌГЃбЙЯТЙ§ЖЩН№ЪєПЩвдДпЛЏКЌгаЫЋМќЛђШўМќЕФЦјЬЌЬўЕФМгЧтЗДгІЁЃ
ЂйвбжЊЃКC2H2ЃЈgЃЉЃЋH2ЃЈgЃЉЈTC2H4ЃЈgЃЉЁїH1=-174.3kJЁЄmolЁЊ1
K1ЃЈ300KЃЉ=3.37ЁС1024
C2H2ЃЈgЃЉЃЋ2H2ЃЈgЃЉ=C2H6ЃЈgЃЉЁїH2ЈT-311.0kJЁЄmolвЛl
K2ЃЈ300KЃЉЈT1.19ЁС1042
дђЗДгІC2H4ЃЈgЃЉЃЋH2ЃЈgЃЉЈTC2H6ЃЈgЃЉЕФЁїH=___kJЁЄmolвЛ1ЃЌKЃЈ300KЃЉ=__ЃЈБЃСєШ§ЮЛгааЇЪ§зжЃЉЁЃ
Ђк2010ФъShethЕШЕУГіввШВдкPdБэУцбЁдёМгЧтЕФЗДгІЛњРэЃЈШчЭМЃЉЁЃЦфжаЮќИНдкPdБэУцЩЯЕФЮяжжгУ*БъзЂЁЃ
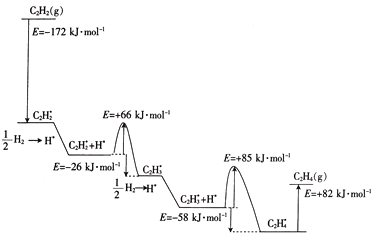
ЩЯЪіЮќИНЗДгІЮЊ____ЃЈЬюЁАЗХШШЁБЛђЁАЮќШШЁБЃЉЗДгІЃЌИУРњГЬжазюДѓФмРнЃЈЛюЛЏФмЃЉЮЊ____kJЁЄmol-1ЃЌИУВНжшЕФЛЏбЇЗНГЬЪНЮЊ____ЁЃ
ЃЈ2ЃЉдкКуШнУмБеШнЦїжаГфШыввЯЉЃЌвЛЖЈЬѕМўЯТЗЂЩњЗДгІC2H4ЃЈgЃЉC2H2ЃЈgЃЉЃЋH2ЃЈgЃЉЁЃввЯЉЕФРыНтТЪЮЊaЃЌЦНКтЪБШнЦїФкЦјЬхзмбЙЧПЮЊPзмЃЌдђЗжбЙpЃЈC2H4ЃЉЈT___ЃЈгУpзмКЭaБэЪОЃЉЁЃ
ЃЈ3ЃЉгУШчЭМзАжУЕчНтКЌCO2ЕФФГЫсадЗЯЫЎШмвКЃЌвѕМЋВњЮяжаКЌгаввЯЉЁЃ
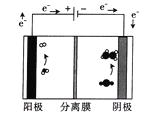
ИУЗжРыФЄЮЊ___ЃЈЬюЁАбєЁБЛђЁАвѕЁБЃЉРызгбЁдёадНЛЛЛФЄЃЛЩњГЩввЯЉЕФЕчМЋЗДгІЪНЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁАШэЕчГиЁБВЩгУвЛеХБЁВужНЦЌзїЮЊДЋЕМЬхЃЌвЛУцЖЦZnЃЌСэвЛУцЖЦMnO2ЁЃЕчГизмЗДгІЮЊZn+2MnO2+H2O=2MnO(OH)+ZnOЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ИУЕчГиЕФе§МЋЮЊZnO
B.ZnЕчМЋИННќШмвКЕФpHВЛБф
C.ЕчГие§МЋЕФЕчМЋЗДгІЮЊ2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.ЕБ0.1molZnЭъШЋШмНтЪБЃЌСїОЕчНтвКЕФЕчзгЕФЮяжЪЕФСПЮЊ0.2mol
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com