
【题目】将3.84 g的铜加入100 mL H2SO4和HNO3混合液中,铜全部溶解并放出无色气体。向溶液中加入2.70 g铝粉,充分反应后过滤,得到溶液X、滤渣Y和气体Z,气体Z遇空气不变色,在标准状况下的体积为672 mL。下列说法正确的是
A. 溶解铝粉的质量为0.54 g
B. 滤渣Y中可能只含有Cu
C. 原混合液中的c(H2SO4):c(HNO3)=9:4
D. 若向溶液X中加入100 mL 2.0 mol·L-1氢氧化钠溶液,充分反应,所得沉淀为4.68 g
【答案】C
【解析】
根据已知条件可知,n(Cu)=![]() =0.06mol,铜与 H2SO4和HNO3混合液反应的离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,消耗n(NO3-)=n(HNO3)=0.04mol,再向该溶液中加入金属铝2.70g计算得到n(Al)=
=0.06mol,铜与 H2SO4和HNO3混合液反应的离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,消耗n(NO3-)=n(HNO3)=0.04mol,再向该溶液中加入金属铝2.70g计算得到n(Al)=![]() ,充分反应后过滤,得到溶液X、滤渣Y和气体Z,气体Z遇空气不变色,说明该气体是H2,在标准状况下的体积为672 mL,即n(H2)=0.03mol,发生离子反应为:2Al+6H+=2Al3++3H2↑,2Al+3Cu2+=2Al3++3Cu,可得到生成氢气消耗金属铝0.02mol,置换反应消耗金属铝0.04mol,所以金属铝有剩余,则滤渣的成分含有金属铝和铜,
,充分反应后过滤,得到溶液X、滤渣Y和气体Z,气体Z遇空气不变色,说明该气体是H2,在标准状况下的体积为672 mL,即n(H2)=0.03mol,发生离子反应为:2Al+6H+=2Al3++3H2↑,2Al+3Cu2+=2Al3++3Cu,可得到生成氢气消耗金属铝0.02mol,置换反应消耗金属铝0.04mol,所以金属铝有剩余,则滤渣的成分含有金属铝和铜,
A.根据上述分析可知,一共消耗金属铝的物质的量为:0.02mol+0.04mol=0.06mol,即消耗铝的质量为:0.06mol×27g/mol=1.62g,故A错误;
B.由分析可知,铝粉有剩余,且置换反应有铜生成,所以滤渣含有铝和铜,故B错误;
C. 根据已知条件可知,n(Cu)=![]() =0.06mol,铜与 H2SO4和HNO3混合液反应的离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,消耗n(NO3-)=n(HNO3)=0.04mol,c(HNO3)=
=0.06mol,铜与 H2SO4和HNO3混合液反应的离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,消耗n(NO3-)=n(HNO3)=0.04mol,c(HNO3)=![]() =
=![]() =0.4mol/L,反应前后n(SO42-)不变,其中生成n(Al3+)=0.06mol,即n(SO42-)=
=0.4mol/L,反应前后n(SO42-)不变,其中生成n(Al3+)=0.06mol,即n(SO42-)=![]() n(Al3+)=0.09mol,所以c(H2SO4)=
n(Al3+)=0.09mol,所以c(H2SO4)=![]() 0.9mol/L,则原混合液中的c(H2SO4):c(HNO3)=9:4,故C正确;
0.9mol/L,则原混合液中的c(H2SO4):c(HNO3)=9:4,故C正确;
D.根据上述分析可知X溶液是硫酸铝溶液,且溶液中Al3+的物质的量为0.06mol,滴加氢氧化钠的物质的量为: 2.0 mol·L-1×0.1L=0.2mol,氢氧化钠过量,发生的离子反应方程式为:Al3++3OH-=Al(OH)3↓, Al(OH)3+OH-=Al3++2H2O,剩余Al(OH)30.04mol,即剩余沉淀3.12g,故D错误,
故选C。


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】将SO2通人BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另种气体A,则产生白色沉淀。制备气体A的试剂不可能是( )
A.Cu和浓硝酸
B.NaOH和浓氨水
C.大理石和稀盐酸
D.MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用只含有铝、铁、铜的工业合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,其实验方案如图所示:

(1)合金与NaOH溶液反应的离子方程式为_________________________________________。
(2)方案中途径②的离子方程式________________________________________________,
D中加入适量盐酸的离子方程式为________________________________________________。
(3)滤渣F的主要成分为____________________
(4)CuSO4溶液中获得胆矾的操作为蒸发浓缩,_____________、过滤_,洗涤、自然干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A. 3gCO2中含有的质子数为1.5NA
B. 1L0.1mol·L-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C. 0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D. 2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程不能达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 测定NaOH溶液的浓度 | 用酸式滴定管量取20.00mL待测NaOH溶液,用甲基橙作指示剂,用标准浓度的盐酸进行滴定 |
B | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
C | 加快铁片与盐酸的反应速率 | 向反应液中滴人几滴CuCl2溶液 |
D | 比较CdS(黄色)与CuS(黑色)的溶解度(已知 | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2SiF6(氟硅酸)是一种基本化工原料,广泛用于制取氟硅酸盐及氟化物等。以氟硅酸和碳酸锂等为原料生产电池级LiF的工艺流程如图:
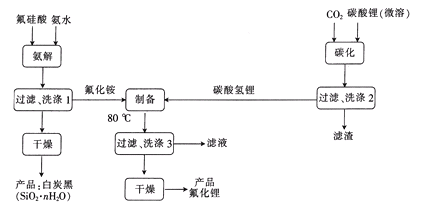
回答下列问题:
(1)生产中采用内衬为聚四氟乙烯或石墨的反应器。聚四氟乙烯的结构简式为____;不用陶瓷设备的原因是____。
(2)“氨解”时发生反应的化学方程式为____,氟化铵的电子式为____。
(3)“碳化”时发生反应的离子方程式为____。
(4)“制备”时产生的气体经分别吸收后返回____和___工序循环使用。
(5)H2SiF6水溶液中存在平衡:SiF62-(aq)+4H2O(1)═Si(OH)4(aq)+4H+(aq)+6F-(aq),该反应的平衡常数表达式为___。
(6)某工厂用纯度为85%的氟硅酸14.4吨和纯度为90%的碳酸锂7.4吨来制备氟化锂,已知流程中氟元素的损耗率为10%,锂元素的损耗率为8%,则最终产品氟化锂为____吨(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中①~⑨是元素周期表中的前四周期相应的元素,请从中选择合适的元素回答问题:
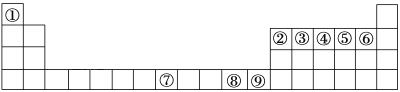
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的________区。元素⑨的价电子排布式为___________。
(2)②、⑥两元素形成的化合物的立体构型为________,其中心原子的杂化轨道类型为____________。
(3)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于_______晶体(填晶体类型)。元素⑦的未成对电子数为_____个。
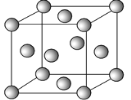
(4)元素⑧的二价阳离子与过量的④的氢化物的水化物反应的离子方程式为_____。元素⑧的单质的晶胞结构如图:已知晶胞的棱长为a cm,NA为阿伏加德罗常数,则该晶体的密度为______g/cm3(用a、NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com